题目内容
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长
 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(1)+3(1分) >(1分)(2)399(1分) 紫外光具有的能量足以使蛋白质分子中的化学键断裂,从而破坏蛋白质分子(1分)(3)TiN>CaO>KCl(1分) 12(1分)(4)CrO2(1分)(5)ACD (不全给1分,全对给2分,有错不给) 三角锥形(1分) 极性(1分)
解析试题分析:(1)A和B为第三周期元素,根据其电离能数据可知,A为Al,B为Mg,故A通常显+3价,A的电负性>B的电负性。(2)1mol光子的能量为E=hvNA=6.63×10-34J·s×3×108m·s-1÷300×10-9m×6.02×1023mol-1=3.99×105J·mol-1="399k" J·mol-1;由此可看出紫外光具有的能量足以使蛋白质分子中的化学键断裂,从而破坏蛋白质分子,使皮肤受伤害。(3)晶格能越大,熔沸点越高,根据晶格能数据可知,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序为TiN>CaO>KCl;MgO晶体与NaCl的晶体结构相似,故一个Mg2+周围和它最邻近且等距离的Mg2+为12个。(4)因为Cr含未成对电子越多,故适合作录音带磁粉原料的为CrO2。(5) [Cu(NH3)4]SO4中存在的化学键类型有离子键、共价键、配位键;NH3分子的空间构型为三角锥型,属于极性分子。
考点:考查原子结构与性质、电离能、晶体结构与性质、分子构型与极性等知识。

、下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
(1)画出元素②的原子结构示意图 。
(2)属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
(3)③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式 。
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
| 键长/(pm) | B—F | B—Cl | B—Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
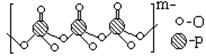
①磷原子的杂化类型为 。
②这种多聚磷酸钠的化学式为 。
(5)已知HF与F-通过氢键结合成HF
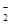 。判断HF
。判断HF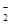 和HF
和HF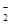 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。。
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
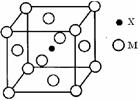
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
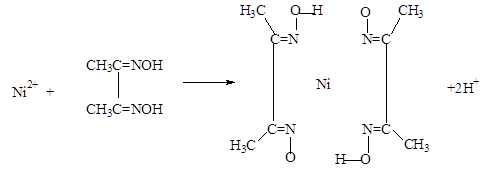
(14分)下表为元素周期表的一部分:
 族 族周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
(1)写出元素④在周期表中的位置: ;
(2)②③⑤的原子半径由大到小的顺序为 ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化
合物的电子式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:
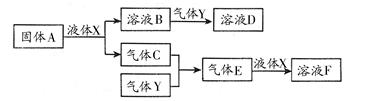
(1)写出固体A与液体X反应的离子方程式: ;
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L