题目内容
【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
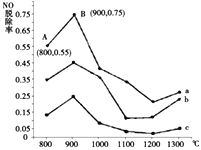
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。
【答案】 2CO(g)+SO2(g)=2CO2(g)+S(l)△H=-270kJ/mol K=![]() bd 1.5×10-4 3∶1 NH3与NO物质的量比值越大,NO的脱除率越高 4NO+3ClO2-+4OH-=4NO3-+2H2O+3Cl- 提高
bd 1.5×10-4 3∶1 NH3与NO物质的量比值越大,NO的脱除率越高 4NO+3ClO2-+4OH-=4NO3-+2H2O+3Cl- 提高
【解析】(1)将第二个方程式×(-1)再加上第一个方程式得到:2CO(g) + SO2(g) = 2CO2(g) + S(l) △H=-270kJ/mol。该反应的平衡常数表达式为:K=![]() 。
。
(2)①反应方程式中的速率比英国等于其系数比,所以应该是v逆(N2)=4v正(O2),选项a错误。反应容器恒压,根据阿伏加德罗定律的推论,同温同压下,气体的密度比等于其摩尔质量(分子量)的比,所以混合气体的密度不变就是混合气体的平均分子量不变。反应中所有物质都是气体,所以气体的总质量不变,平均分子量也不变,得到气体的总物质的量不变,因为两边系数不等,所以气体物质的量不变说明反应达平衡,进而说明选项b正确。浓度的比例关系,不能说明达平衡,因为没有说明比例不变,有可能是某个瞬间达到这个关系,过了这个瞬间,又发生了变化,所以选项c错误。单位时间内断裂12molN-H键说明有4mol氨气参与了反应,同时断裂4molN≡N键说明有4mol氮气进行了逆反应,所以说明反应达平衡,选项d正确。答案为bd。
②从图中得到A点的NO脱除率为55%,B点的NO脱除率为75%,即从A到B时NO的脱除率增加了20%,所以反应的NO为6×10-4×20%=1.2×10-4mg/m3,时间为0.8s,所以反应的速率为![]() mg/(m3·s)。
mg/(m3·s)。
③NH3与NO的物质的量之比越大,NO的脱除率越高,所以曲线b对应的NH3与NO的物质的量之比是3:1。
(3)混合气体通过NaClO2的溶液后,N元素主要转化为NO3-,所以NO应该被氧化为NO3,方程式为:4NO+3ClO2-+4OH-=4NO3-+2H2O+3Cl-。增大压强平衡正向移动,NO的转化率升高。

【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是( )
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 温度升高H2的体积分数减小
D. 该反应的化学平衡常数越大,反应物的转化率越低
