题目内容
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
【答案】A
【解析】
根据原子守恒可知反应中还有KCl生成,在反应2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O中,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价由0降低为-1价,以此来解答。
A.Fe元素的化合价由+3价升高为+6价,失去3个电子,因此每转移1mole-,可以得到高铁酸钾的质量是![]() ,故A错误;
,故A错误;
B.根据原子守恒可知□处的物质应为KCl,故B正确;
C.Fe元素的化合价升高,失去电子被氧化,故C正确;
D.氧化剂的氧化性大于氧化产物的氧化性,则反应条件下氧化性是Cl2>K2FeO4,故D正确;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
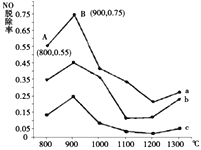
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
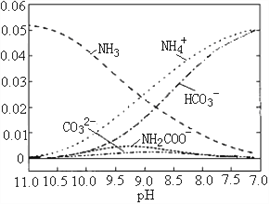
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。
【题目】钻(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
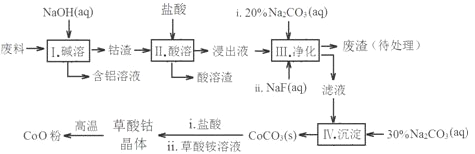
已知:LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目________。
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式_______________。
(3)步骤II所得废渣的主要成分除了LiF外,还有________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是___________。
(5)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。己知:M(CoC2O42H2O)=183g/mol。
温度范围/℃ | 固体质量/g |
150--210 | 8.82 |
290--320 | 4.82 |
890--920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为_____。加热到210--290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________。温度高于890℃时,固体产物发生分解反应,固体产物为__________。