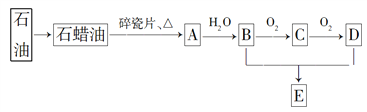
题目内容
【题目】下列除杂方案正确的是( )
A.氢氧化钠溶液中混有氢氧化钡(硫酸铜溶液)
B.二氧化碳气体中混有氯化氢(氢氧化钠溶液)
C.硝酸铜溶液中混有硝酸银(铜粉)
D.氧化钙中混有碳酸钠(稀盐酸)
【答案】C
【解析】A.二者均与硫酸铜溶液反应,不能除杂,A不符合题意;
B.二者均与NaOH反应,不能除杂,B不符合题意;
C.Cu与硝酸银反应生成硝酸铜和Ag,则反应后过滤可除杂,C符合题意;
D.二者均与稀盐酸反应,不能除杂,D不符合题意;
所以答案是:C.

 阅读快车系列答案
阅读快车系列答案【题目】汽车尾气中通常含有NxOy和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化进而减少汽车尾气对大气的污染。
(1)己知:①CO的燃烧热△H1=-283kJ·mol-1 ②N2(g)+O2(g) =2NO(g) △H2 =+183kJ·mol-1
由此写出NO和CO反应的热化学反应方程式________________________________。
(2)一定温度下,向2L密闭容器中充入4.0mo1NO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
0 min | 5 min | 10 min | 15 min | 20 min | |
c(NO2)/ mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
C(N2)/ mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5l0min,用N2的浓度变化表示的反应速率为__________________。
②以下表述能说明该反应己达到平衡状态的是________。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡 ______________(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= __________ (保留两位有效数字)。
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极):
①写出该电池的负极反应式____________________________;
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=__________。(忽略溶液的体积变化,己知1g2=0.3,lg5=0.7)
【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
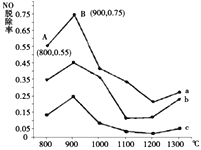
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。