题目内容
15.下列观点正确的是( )| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
分析 A、先根据碳链异构书戊烷,再根据双键位置异构书写戊烯的同分异物体,烯烃的同分同分异构体还可能为环烷烃;
B、丙烯不是对称结构,与HCl发生加成反应,氢原子和氯原子上的位置可以不一样;
C、组成为CnH2n的烃,也可以是环烷烃;
D、能使溴水或酸性KMnO4溶液褪色的C4H8的物质为烯烃;
解答 解:A、戊烷有3种同分异构体: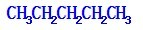 ,
, ,
,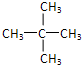 ,对应的戊烯分别为:3种,3种,0种,所以2-戊烯的同分异构体属于烯烃的同分异构体有5种,属于环烷烃的有3种:环戊烷,甲基环丁烷,1,1-二甲基环丙烷,1,2-二甲基环丙烷,则2-戊烯的同分异构体数目为8种,故A错误;
,对应的戊烯分别为:3种,3种,0种,所以2-戊烯的同分异构体属于烯烃的同分异构体有5种,属于环烷烃的有3种:环戊烷,甲基环丁烷,1,1-二甲基环丙烷,1,2-二甲基环丙烷,则2-戊烯的同分异构体数目为8种,故A错误;
B、丙烯不是对称结构,与HCl发生加成反应,可以得到1-氯丙烷和2-氯丙烷,故B错误;
C、组成为CnH2n的烃,当n=3时,可以丙烯或环丙烷,具有同分异构体,故C错误;
D、能使溴水或酸性KMnO4溶液褪色的C4H8的物质为丁烯,有三种同分异构体:CH3CH2CH=CH2,CH3CH=CHCH3,CH2=CH(CH3)2,故D正确;
故选D.
点评 本题考查有机物的性质与同分异构体,题目难度不大,注意同分异构体的书写方法,难度不大.

练习册系列答案
相关题目
18.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )
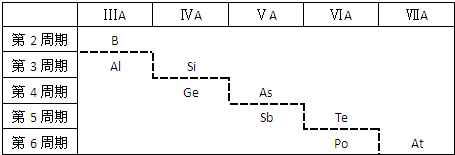

| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
6.某无色溶液,只可能含有下表中的几种离子.
进行如下实验分析其组成:
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
10.对于反应:A+B?C,下列条件的改变一定能使化学反应速率加快的是( )
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
4.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素描述正确的是( )
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
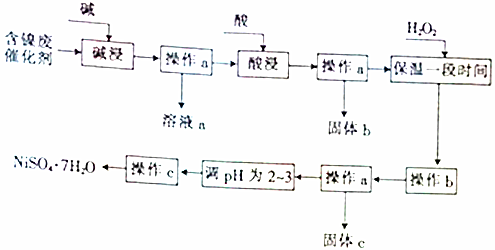
5.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外,还需要的主要仪器有漏斗、蒸发皿.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.

 .
.

 .
. .
.