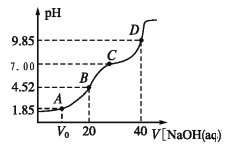
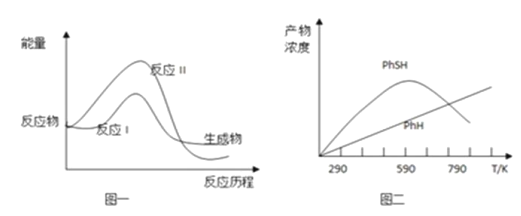
题目内容
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为 77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,(已知 SCl2的沸点为 50℃).
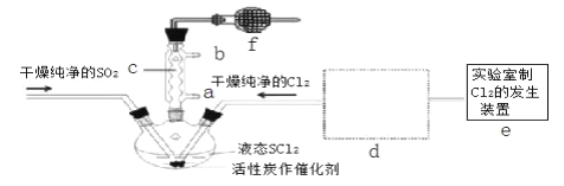
回答以下问题:
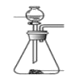
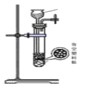
(1)下列四种制备 SO2的方案中最佳选择是____________________________
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHCO3固体 |
(2)以 MnO2和浓盐酸为原料制备 Cl2的离子方程式为___________________________
(3)仪器 f 的作用是_________________________________________________
(4)d 的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是_______________。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是 _________________________
(6)若用 SOCl2作 FeCl36H2O 的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量 FeCl36H2O 于试管中,加入过量 SOCl2,振荡,往试管中加水溶解,滴加____________或________溶液,证明脱水过程发生了氧化还原反应。
【答案】 A MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 防止空气中的水蒸气进入冷凝管,产品变质,吸收尾气 SO2、Cl2,防止污染空气 饱和食盐水,浓硫酸 蒸馏 BaCl2 或 KSCN 或 K3[Fe(CN)6]溶液
Mn2++Cl2↑+2H2O 防止空气中的水蒸气进入冷凝管,产品变质,吸收尾气 SO2、Cl2,防止污染空气 饱和食盐水,浓硫酸 蒸馏 BaCl2 或 KSCN 或 K3[Fe(CN)6]溶液
【解析】(1)A、70%H2SO4+K2SO3会产生二氧化硫,可不加热,故A正确;B中18.4mol·L-1的硫酸太浓,其中水分过少,硫酸仍然以分子形式存在,浓硫酸粘稠,与铜反应制取二氧化硫,二氧化硫不易逸出,故B错误。C中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根离子而无法得到二氧化硫。D、加热NaHCO3固体,产生二氧化碳,故D错误;故选A。(2)以 MnO2和浓盐酸为原料制备 Cl2的离子方程式为MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;(3)f有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。(4)装置e中产生的Cl2混有水、HCl,则d框内包含一个盛装饱和食盐水的气瓶除去HCl,一个盛装浓硫酸的干燥装置,即:饱和食盐水,浓硫酸 ;(5)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,则采用蒸馏的方法即可将之分离;(6)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;故答案为:BaCl2或 KSCN 或 K3[Fe(CN)6]溶液。
Mn2++Cl2↑+2H2O;(3)f有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。(4)装置e中产生的Cl2混有水、HCl,则d框内包含一个盛装饱和食盐水的气瓶除去HCl,一个盛装浓硫酸的干燥装置,即:饱和食盐水,浓硫酸 ;(5)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,则采用蒸馏的方法即可将之分离;(6)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;故答案为:BaCl2或 KSCN 或 K3[Fe(CN)6]溶液。

【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .