题目内容
【题目】已知:pKa=lgKa,25℃时,H2A 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol/LNaOH 溶液滴定 20 mL 0.1 mol/LH2A 溶液的滴定曲线如图所示。下列说法正确的是( )
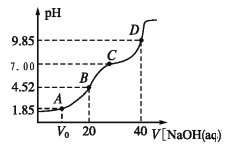
A. A 点所得溶液中:V0<10 mL
B. B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. C 点所得溶液中:c(A2-)= c(Na+)—c(HA-)—c(H2A)
D. D 点所得溶液中 A2-水解平衡常数 Kh1=107.19
【答案】A
【解析】A.a点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol·L-1,H2A的一级电离平衡常数为Ka1=c(H+)c(HA-)/c(H2A)=10-1.85mol·L-1,所以c(H+)=Ka1,表明溶液中c(NaHA)=c(H2A),若恰好是10mLNaOH,反应起始时存在c(NaHA)=c(H2A),平衡时c(H2A)<c(NaHA),因此所加NaOH体积需<10mL,会得到平衡时c(NaHA)=c(H2A),即V0<10mL,故A正确;B.b点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,溶液中存在质子守恒,c(H2A)+c(H+)=c(A2-)+c(OH-),故B错误;C、由电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),pH=7时,c(Na+)=2c(A2-)+c(HA-),故C错误;D、d点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,此时Na2A水解使溶液显碱性,溶液的pH为9.85,发生水解的方程式为A2-+H2O![]() HA-+OH-,则A2-水解平衡常数Khl=c(HA-)c(OH-)/c(A2-)=Kw/Ka2=10-14/10-7.19=10-6.81,故D错误。故选A。
HA-+OH-,则A2-水解平衡常数Khl=c(HA-)c(OH-)/c(A2-)=Kw/Ka2=10-14/10-7.19=10-6.81,故D错误。故选A。

【题目】如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
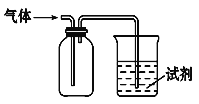
选项 | 试剂 | 现象 | 结论 |
A | 溴水 | 溶液褪色 | SO2有氧化性 |
B | H2S溶液 | 淡黄色沉淀 | SO2有氧化性 |
C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性、没有漂白性 |
A. A B. B C. C D. D
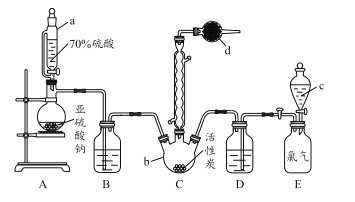
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为 77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,(已知 SCl2的沸点为 50℃).
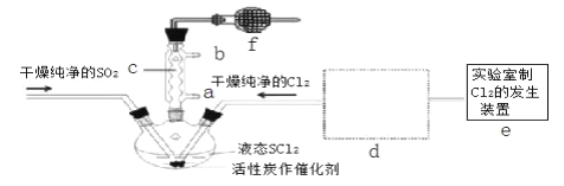
回答以下问题:
(1)下列四种制备 SO2的方案中最佳选择是____________________________
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHCO3固体 |
(2)以 MnO2和浓盐酸为原料制备 Cl2的离子方程式为___________________________
(3)仪器 f 的作用是_________________________________________________
(4)d 的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是_______________。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是 _________________________
(6)若用 SOCl2作 FeCl36H2O 的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量 FeCl36H2O 于试管中,加入过量 SOCl2,振荡,往试管中加水溶解,滴加____________或________溶液,证明脱水过程发生了氧化还原反应。