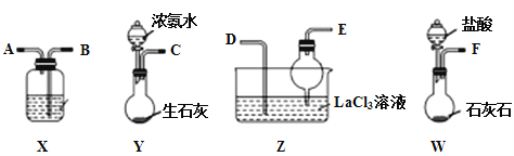
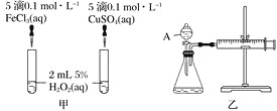
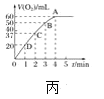
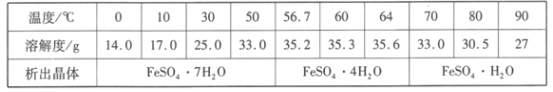
题目内容
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置_____________.
(2)D的最高价氧化物的水化物电子式___________,所含化学键类型____________.
(3)B、C、D、E简单离子半径由大到小顺序为_____________(用离子符号表示).
(4)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:_____________________________.
【答案】第三周期第ⅥA族 ![]() 离子键、共价键 S2->N3->O2->Na+ NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O
离子键、共价键 S2->N3->O2->Na+ NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O
【解析】
A、B、C、D、E均为短周期元素,且原子序数依次增大,A最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素;B元素的单质在空气中含量最多,则B为N元素;C元素在地壳中含量最多,则C为O元素;D元素在同周期中金属性最强,原子序数大于氧,处于第三周期IA族,故D为Na;常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积,则E为S元素。
(1)E为硫元素,在元素周期表中的位置:第三周期第ⅥA族,因此,本题正确答案是:第三周期第ⅥA族;
(2) Na的最高价氧化物的水化物是氢氧化钠,电子式为![]() ,所含化学键类型由离子键和共价键。
,所含化学键类型由离子键和共价键。
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径: S2->N3->O2->Na+
(4)由C、N、O与H元素组成的一种常见的酸式盐为NH4HCO3,D的最高价氧化物对应的水化物为NaOH,碳酸氢铵与过量的NaOH反应的离子方程式为: NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
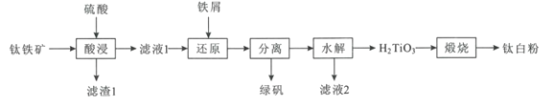
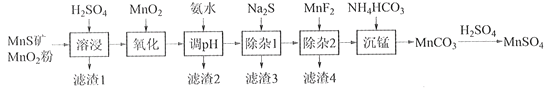
口算题卡河北少年儿童出版社系列答案【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。