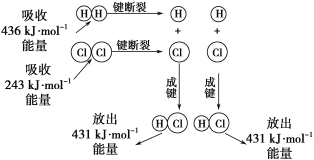
题目内容
【题目】钛白粉(TiO2)作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含FeTiO3及少量的CaO、Fe2O3、SiO2)为原料生产钛白粉的工艺流程如图:
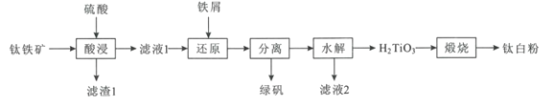
回答下列问题:
(1)“酸浸”是用硫酸在温度为150~200℃下溶煮钛铁矿,“滤液1”中的主要成分中含有TiOSO4,则“酸浸”中主要发生的反应方程式为___。
(2)“滤渣1”的主要成分有___。
(3)“还原"中加入过量铁屑的目的是___。
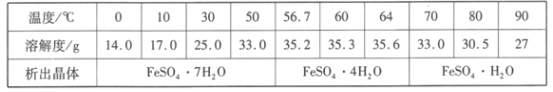
(4)硫酸亚铁晶体的溶解度如下表所示,其中绿矾(FeSO4·7H2O)容易被氧化,则“分离”得到绿矾的操作为___。
(5)“水解”需要加热至90℃的目的是___。
(6)“滤液2”可返回到___工序循环利用。
(7)工业上将钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体,反应的化学方程式为___,最后在氩气氛围和加热的条件下用金属镁还原TiCl4制取性能优越的金属钛。
【答案】FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O SiO2、CaSO4 将溶液中的Fe3+还原为Fe2+,防止Fe2+被氧化 真空加热浓缩,低于50℃降温结晶,过滤(洗涤) 升高温度,促进TiOSO4的水解 酸浸 TiO2+2Cl2+2C
TiOSO4+FeSO4+2H2O SiO2、CaSO4 将溶液中的Fe3+还原为Fe2+,防止Fe2+被氧化 真空加热浓缩,低于50℃降温结晶,过滤(洗涤) 升高温度,促进TiOSO4的水解 酸浸 TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
【解析】
根据流程和题意有:FeTiO3及少量的CaO、Fe2O3、SiO2,加入硫酸后生成TiOSO4、FeSO4、Fe2(SO4)3和微溶的CaSO4,SiO2不反应;滤液1中加入铁粉将三价铁转化为二价铁,再将绿矾FeSO47H2O分离出来,TiOSO4经过水解后得到H2TiO3和硫酸,最后煅烧得到钛白粉(TiO2)。
(1)钛铁矿FeTiO3中铁为+2价,则FeTiO3与硫酸反应生成TiOSO4和FeSO4,结合反应条件和质量守恒定律,则“酸浸”中主要发生的反应方程式为FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O;
TiOSO4+FeSO4+2H2O;
(2)根据分析,与硫酸反应后生成的CaSO4微溶,SiO2与硫酸不反应,则 “滤渣1”的主要成分有SiO2、CaSO4;
(3)滤液1中有Fe2(SO4)3,后面要得到绿矾FeSO47H2O,加入铁屑能将溶液中的Fe3+还原为Fe2+,同时Fe2+易被氧化,加入铁屑能防止Fe2+被氧化,所以加入过量铁屑的目的是将溶液中的Fe3+还原为Fe2+,防止Fe2+被氧化;
(4)根据溶解度表,高于50℃时得不到FeSO4·7H2O,所以降温结晶温度不能高于50℃,二价铁不稳定,具有还原性,易被空气中的氧气氧化为三价铁,所以得到绿矾的操作为真空加热浓缩,低于50℃降温结晶,过滤(洗涤);
(5)水解时吸热,升高温度,能促进水解,所以需要加热至90℃的目的是升高温度,促进TiOSO4的水解;
(6)TiOSO4水解时生成H2TiO3和硫酸,故“滤液2”中含有硫酸,可返回到酸浸工序循环利用。
(7)钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体是CO,反应物有TiO2、Cl2、C,生成物有TiCl4、CO,配平后得到反应的化学方程式为TiO2+2Cl2+2C![]() TiCl4+2CO。
TiCl4+2CO。

【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置_____________.
(2)D的最高价氧化物的水化物电子式___________,所含化学键类型____________.
(3)B、C、D、E简单离子半径由大到小顺序为_____________(用离子符号表示).
(4)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:_____________________________.