题目内容
20.已知1mol氢气完全燃烧生成水蒸气时放出242kJ的能量,且氧气中1mol O═O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H-O键形成时放出463kJ的能量,则氢气中1mol H-H键断裂时吸收的能量为( )| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
分析 化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,依此结合反应方程式进行计算.
解答 解:氢气完全燃烧生成水蒸气是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为Q,根据方程式:2H2+$\frac{1}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$H2O,则:242kJ=2×463kJ-(Q+$\frac{1}{2}$×496kJ),解得Q=436KJ,
故选A.
点评 本题考查学生化学反应中的能量变化知识,注意把握反应热与反应物、生成物键能的关系,难度不大.

练习册系列答案
相关题目
11.一定温度下,固定容器的密闭容器中进行的可逆反应:A(g)+B(g)═C(g)+D(g),当下列物理量不再改变时,表明反应已达到平衡的是( )
| A. | 单位时间内有1mol A生成,有1molC消耗 | |
| B. | 混合气体的密度不变 | |
| C. | A的消耗速率与D的消耗速率相同 | |
| D. | B物质的相对分子质量不变 |
8.某单烯烃与H2加成后的产物是: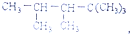 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
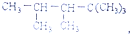 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 2种 |
15.下列说法不正确的是( )
| A. | pH<7的雨水就是酸雨 | |
| B. | 绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的影响 | |
| C. | 含氮、磷的大量污水任意排放是导致水华的主要原因 | |
| D. | 垃圾是放错地方的资源,应该分类回收利用 |
5.以0.10mol/L的氢氧化钠溶液滴定某一元弱酸HA的滴定曲线如图所示.下列表述正确的是( )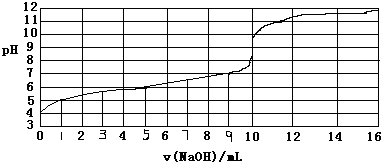

| A. | 此实验可以选用酚酞作指示剂 | |
| B. | 弱酸HA的浓度约为1×10-4mol/L | |
| C. | 根据已知条件,弱酸HA的电离常数(Ka)不能计算 | |
| D. | 当NaOH体积为9ml时,恰好完全中和反应 |
9.下列与有机物的结构、性质有关的叙述不正确的是( )
| A. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| B. | C5H12有3种同分异构体 | |
| C. | 氨基酸、淀粉均属于高分子化合物 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |