题目内容
12.NH3经一系列反应可以得到HNO3,如图甲所示.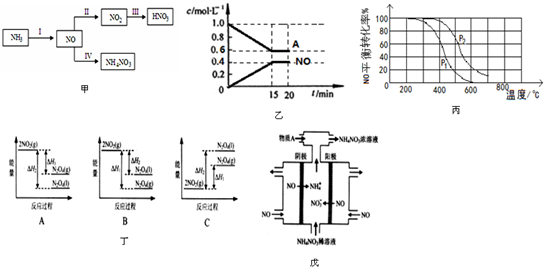
(1)Ⅰ中,在一定条件下,将2.0mol NH3、2.4mol O2通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图乙所示:
A物质为NH3,0~15min H2O的平均速率v(H2O)=0.040mol/(L•min).(保留两位有效数字)
(2)Ⅱ中,2NO(g)+O2?2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图丙).
①比较p1、p2的大小关系:P1<P2.
②随温度升高,该反应平衡常数变化的趋势是减小.
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸.
①已知:2NO2(g)?N2O4(g)△H1 2NO2(g)?N2O4(l)△H2
图丁能量变化示意图中,正确的是(选填字母)A.
②N2O4与O2、H2O化合的化学方程式是:2N2O4+O2+2H2O=4HNO3.
(4)IV中,电解NO制备 NH4NO3,其工作原理如图戊所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是氨气,说明理由:根据反应8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的HNO3多.
分析 (1)反应I为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,A与NO的物质的量浓度变化量相等,故A为NH3;
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于其化学计量数之比计算v(H2O);
(2)①反应2NO(g)+O2(g)?2N02(g)的正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,平衡时NO的转化率增大;
②由图可知,压强一定时,随温度升高,NO的转化率减小,说明升高温度平衡逆反应方向移动;
(3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)?N2O4(l)为放热反应,同种物质液态时能量比气态时能量低;
②N2O4与O2、H2O化合生成硝酸,根据得失电子守恒和原子守恒写出反应的方程式;
(4)电解NO制备NH4NO3,阳极反应为5NO-15e-+10H2O=5NO3-+20 H+,阴极反应为:3NO+15e-+18H+=3NH4++3H2O,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,据此判断.
解答 解:(1)反应I为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,A与NO的物质的量浓度变化量相等,故A为NH3;
v(NO)=$\frac{0.4mol/L}{15min}$,速率之比等于其化学计量数之比,则v(H2O)=$\frac{6}{4}$v(NO)=$\frac{6}{4}$×$\frac{0.4mol/L}{15min}$=0.040mol/(L.min),
故答案为:NH3;0.040;
(2)①反应2NO(g)+O2(g)?2N02(g)的正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,平衡时NO的转化率增大,由图可知P2时NO的转化率大,则P2时压强大,即P1<P2;
故答案为:P1<P2;
②由图可知,压强一定时,随温度升高,NO的转化率减小,说明升高温度平衡逆反应方向移动,即升高温度平衡常数K减小,
故答案为:减小;
(3)①降低温度将NO2(g)转化为N2O4(l),说明反应2NO2(g)?N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,
故答案为:A;
②N2O4与O2、H2O化合生成硝酸,其反应的化学方程式为:2N2O4+O2+2H2O=4HNO3,
故答案为:2N2O4+O2+2H2O=4HNO3;
(4)电解NO制备NH4NO3,阳极反应为5NO-15e-+10H2O=5NO3-+20 H+,阴极反应为:3NO+15e-+18H+=3NH4++3H2O,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,
故答案为:氨气;根据反应8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的HNO3多.
点评 本题考查物质的量浓度随时间变化曲线及反应速率计算、化学平衡图象及影响因素、平衡常数影响因素、能量变化图象、电解原理等,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

| A. | Na2O、MgO、Al2O3都是碱性氧化物 | |
| B. | 硬铝、黄铜、钢铁都属于合金 | |
| C. | 纤维素、硝化纤维、纤维二糖都是高分子 | |
| D. | 蔗糖、乙醇、液氯都是非电解质 |
| A. | 标准状况下,46gCH4中含有的分子数为NA | |
| B. | 通常状况下,14gCO含有的电子数目为7NA | |
| C. | lL0.2mol•L-1的CH3COOH溶液中,H+数目为0.2NA | |
| D. | 0.1molCu与400mLlmol•L-1稀硝酸反应后,溶液中的NO3数目为为0.2NA |
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
| A. | I-和IO-都是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2被氧化 |
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 工业上以石油为原料生产乙烯 | |
| C. | 油脂不是酯 | |
| D. | 充分燃烧后只生成CO2和H2O的有机物就是烃 |
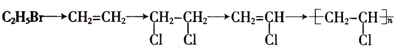
| A. | 消去反应 | B. | 取代反应 | C. | 加成反应 | D. | 加聚反应 |
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海洋中含有丰富的矿产资源,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 加热可杀灭中东呼吸综合征(MERS)冠状病毒,因为病毒的蛋白质受热变性 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 $\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
| 金属离子 | Fe2+ | Fe3+ | Al3- | Mg2+ | Ni2+ |
| 开始沉淀的pH值 | 6.5 | 1.6 | 3.4 | 9.4 | 7.2 |
| 完全沉淀的pH值 | 9.7 | 3.2 | 5.4 | 12.4 | 9.3 |