题目内容
15.下列说法不正确的是( )| A. | pH<7的雨水就是酸雨 | |
| B. | 绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的影响 | |
| C. | 含氮、磷的大量污水任意排放是导致水华的主要原因 | |
| D. | 垃圾是放错地方的资源,应该分类回收利用 |
分析 A.“酸雨”是指pH<5.6的雨水;
B.“绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染;
C.含氮、磷的大量污水任意排放会导致水体富营养化,产生水华、赤潮等现象;
D.垃圾中蕴藏着巨大能力,需要分类回收利用,以便节约能源、降低污染.
解答 解:A.正常的雨水常呈微酸性,这是由于在雨水中溶解了二氧化碳,通常所说的酸雨是指pH<5.6的雨水,当空气受二氧化硫或二氧化氮的污染时雨水的pH小于5.6则为酸性,故A错误;
B.传统的化学工业给环境带来的污染已经十分严重,绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染,故B正确;
C.含氮、磷的大量污水任意排放会导致水体富营养化,会出现水华现象,故C正确;
D.垃圾中含有丰富的能量,应该进行分类回收利用,既减小了污染,又节约能源,故D正确;
故选A.
点评 本题考查了常见生活环境的污染及治理、酸雨的成因等知识,题目难度中等,注意掌握生活污染及治理方法,明确正常与水的pH大小,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.在下列溶液中一定能够大量共存的离子组是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Cu2+ | |
| B. | 在pH=1的溶液中:Fe2+、Mg2+、NO3-、ClO- | |
| C. | c(H+)=10-12 mol•L-1的溶液:Na+、S2-、AlO2-、SO32- | |
| D. | 使石蕊试液变红的溶液:K+、NH4+、I-、MnO4- |
3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,46gCH4中含有的分子数为NA | |
| B. | 通常状况下,14gCO含有的电子数目为7NA | |
| C. | lL0.2mol•L-1的CH3COOH溶液中,H+数目为0.2NA | |
| D. | 0.1molCu与400mLlmol•L-1稀硝酸反应后,溶液中的NO3数目为为0.2NA |
10.下列说法错误的是( )
| A. | 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 | |
| B. | 反应Hg(1)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 | |
| C. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
20.已知1mol氢气完全燃烧生成水蒸气时放出242kJ的能量,且氧气中1mol O═O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H-O键形成时放出463kJ的能量,则氢气中1mol H-H键断裂时吸收的能量为( )
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
7.已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:第一步:H2O2+I-→H2O+IO- (慢);第二步:H2O2+IO-→H2O+O2+I- (快),下列有关反应的说法正确的是( )
| A. | I-和IO-都是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2被氧化 |
4.按下列路线制备聚氯乙烯,各步骤中不涉及的反应类型是( )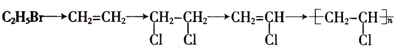
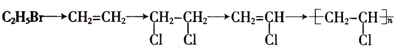
| A. | 消去反应 | B. | 取代反应 | C. | 加成反应 | D. | 加聚反应 |
5.下列事实与胶体性质关的是( )
| A. | 工业生产中常用静电除尘装置除去废气中的固体悬浮物 | |
| B. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| C. | 一束平行光线照射豆浆时,可看到光亮的通路 | |
| D. | 万里长江流入大海处,形成长江三角洲 |