题目内容
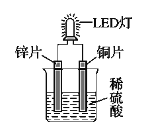
【题目】获得“863”和中科院“百人计划”支持的绿色环保型铝碘电池已研制成功。电极为铝、石墨,电解液为AlI3溶液,电池总反应:2AlI3 ![]() 2Al +3I2,下列说法中正确的是( ):
2Al +3I2,下列说法中正确的是( ):
A. 放电时的负极反应Al-3e-=Al3+,导线中通过3.612×1024个电子时负极质量减少27g
B. 充电时电子的流动方向:电源负极→Al电极→电解质溶液→石墨电极→电源正极
C. 消耗相同质量的金属时,用锂做负极转移电子的物质的量比用铝时的多
D. 乙醇、乙酸等含活泼氢的有机物可用作该铝碘电池的电解质
【答案】C
【解析】
A.放电时,电池的总反应为2Al+3I2=2AlCl3,Al的化合价升高,失去电子,作负极,电极反应方程式为Al-3e-=Al3+。导线中通过3.612×1024个电子,电子的物质的量![]() ,转移6mol电子,消耗2molAl,其质量为2mol×27g·mol-1=54g,A项错误;
,转移6mol电子,消耗2molAl,其质量为2mol×27g·mol-1=54g,A项错误;
B.电子不能经过电解质溶液,所以电子的流动方向不可能为Al电极→电解质溶液→石墨电极。充电时,电子的流动方向应为电源负极→Al电极,石墨电极→电源正极,B项错误;
C.假设金属质量均为1g,Li作负极时,1molLi失去1mol电子,转移的电子的物质的量![]() ;Al作负极时,1molAl失去3mol电子,转移的电子的物质的量
;Al作负极时,1molAl失去3mol电子,转移的电子的物质的量![]() ,相同质量情况下,Li失去的电子更多,C项正确;
,相同质量情况下,Li失去的电子更多,C项正确;
D.乙醇为非电解质,其溶液不导电,不能做电解质溶液。乙酸也不能做电解质溶液,由于铝会直接与乙酸反应生成H2。D项错误;
本题答案选C。

【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②