题目内容
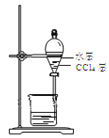
【题目】用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)仔细观察实验装置,图中是否缺少一种玻璃仪器,如果缺少,缺少的是______________(填仪器名称,如果不缺少,此空不填),图中是否有不妥之处,如果有请指出:________________________(如果没有,此空不填)。

(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将______(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”或“不相等”),简述理由:____________________________。
【答案】环形玻璃搅拌棒 大烧杯口与小烧杯口不相平,且未填满碎纸条 偏大 相等 中和热是一个定值,与实验中药品的用量多少无关
【解析】
(1)实验测定过程中要使用环形玻璃棒进行搅拌保证反应快速彻底进行;中和热测定实验成败的关键是保温工作;
(2)不加盖纸板,热量会散失,测定中和反应放出的热量数值偏小,放热反应焓变小于0;
(3)根据中和热定义分析解答。
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大烧杯口与小烧杯口不相平,且未填满碎纸条;
(2)大烧杯上如不盖硬纸板,会有部分热量散失,则求得的中和热数值偏小,中和反应为放热反应,焓变小于0,ΔH偏大;
(3)如果用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液进行反应,与上述实验相比,反应生成的水增多,则所放出的热量也增多;根据中和热的定义可知,中和热是指生成1mol水放出的热量,经折算后,最终求出的中和热是相等的。