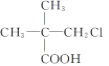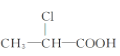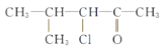题目内容
【题目】A、B、C、D、E、F、X为周期表前四周期的元素,A→F原子序数依次增大。A位于第一周期,B原子有3个不同的能级,各能级的电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的电子层结构;F元素有“生物金属”之称,F4+离子和氩原子核外电子排布相同;X是第三周期电负性最大的元素。回答下列问题:
(1)F基态原子的核外电子排布式______________ ,用过量的E粉与 FX4高温条件下反应生成金属F,该化学方程式为___________________。
(2)在A与上述元素形成的分子中,中心原子采取sp3杂化的是________________(写出两种)。
(3)下图是BD2分子的晶胞模型,图中显示出的BD2分子数为14个。实际上一个BD2晶胞中含有__________个BD2分子。
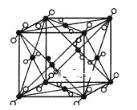
![]() 代表一个BD2分子
代表一个BD2分子
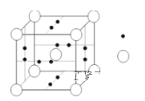
(4)B元素可形成B60单质,从晶体类型来看B60属于__________晶体。科学家把B60与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图(白球(C60)位于立方体的体心和顶点,小黑球(K)则位于立方体的面上),该化合物中B60与钾原子个数比为________________。
(5)已知单晶锗、晶体硅与金刚石的晶体类型完全相同,下图所示是金刚石的晶胞结构,请回答:
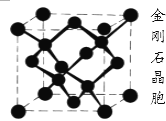
在单晶锗的一个晶胞内含有__________个锗原子。
(6)若向CuSO4溶液中加入少量氨水生成蓝色絮状沉淀,继续加入过量氨水沉淀溶解,得到深蓝色的透明溶液,最后向该溶液中加入一定量的乙醇,所析出晶体的化学式为________。
【答案】1s22s22p63s23p63d24s2 2Mg+TiCl4![]() Ti+2MgCl2 CH4、NH3、H2O 4 分子晶体 1:3 8 [Cu(NH3)4]SO4H2O
Ti+2MgCl2 CH4、NH3、H2O 4 分子晶体 1:3 8 [Cu(NH3)4]SO4H2O
【解析】
A位于第一周期,则A是H或者He,根据提问,A会与其他元素形成化合物,则A为H。B的基态原子有3个不同的能级,各能级中电子数相等,B的电子排布式为1s22s22p2,B为C。D的基态原子2p能级上未成对电子数与B原子相同,且D能形成-2价的离子,则D为O。根据B、C、D原子序数依次增大,C为N元素。O2-和E2+具有相同的核外电子排布,则E为Mg,F4+与Ar原子的核外电子层结构相同,F的原子序数为22,F为Ti。X是第三周期电负性最大的元素,则X为Cl。
(1)F为22号元素Ti,其基态原子的核外电子排布式为1s22s22p63s23p63d24s2;E为Mg,和TiCl4高温下反应生成Ti单质,为置换反应,方程式为2Mg+TiCl4![]() Ti+2MgCl2;
Ti+2MgCl2;
(2)中心原子通过sp3杂化形成分子,则说明中心原子含有4个价电子对,CH4、NH3、H2O都含有4个价电子对,答案为CH4、NH3、H2O;
(3)在CO2的晶胞中,有8个CO2分子位于顶点,为8个晶胞所共有,则有1/8个CO2分子属于这个晶胞;有6个CO2分子位于面上,为2个晶胞所共用,则有1/2个CO2分子属于这个晶胞,所以该晶胞一共有![]() 个CO2;
个CO2;
(4)C60属于一个分子,C60的晶体属于分子晶体;在该晶胞中,有8个C60位于顶点,为8个晶胞所共有,则有1/8个C60属于这个晶胞,则该晶胞中有![]() ;有6个K位于面上,为2个晶胞所共有,则有1/2个K属于这个晶胞,则该晶胞中有
;有6个K位于面上,为2个晶胞所共有,则有1/2个K属于这个晶胞,则该晶胞中有![]() ,则C60与K的比例为1:3;
,则C60与K的比例为1:3;
(5)类似于金刚石的晶胞中,有8个原子位于顶点,为8个晶胞所共有,则有1/8个原子属于这个晶胞;有6个原子位于面上,为2个晶胞所共有,则有1/2个原子属于这个晶胞;有4个原子位于晶胞内,为这个晶胞所独有,完全属于此晶胞,则一共有![]() 个原子;
个原子;
(6)按照题意,深蓝色的透明溶液中含有四氨合铜离子,加入乙醇析出沉淀,此沉淀为[Cu(NH3)4]SO4H2O。

【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

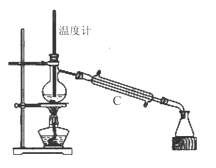
(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
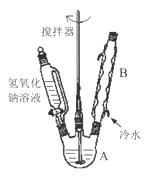
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。