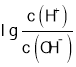题目内容
【题目】现有一包铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸溶解,生成的气体全部是NO, 待粉末完全溶解后,逐滴加入3molL-1 的氨水,产生沉淀的物质的量与加入氨水的体积关系如图。
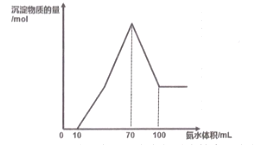
(1)写出图中滴加氨水10~100mL 的过程中铜元素参与反应的离子方程式_________。
(2)所用硝酸的物质的量浓度为______mol L-1;写出简要计算过程______。
【答案】Cu2++2NH3·H2O=Cu(OH)2↓+2![]() ,Cu(OH)2+4
,Cu(OH)2+4![]() =
=![]() +2OH-+4H2O 2.7 过程:根据沉淀所用氨水0.18mol,得显酸性的硝酸根为 0.03mol; 根据稀硝酸和金属反应的关系,求得硝酸的物质的量为 0.03+
+2OH-+4H2O 2.7 过程:根据沉淀所用氨水0.18mol,得显酸性的硝酸根为 0.03mol; 根据稀硝酸和金属反应的关系,求得硝酸的物质的量为 0.03+![]() ×0.18mol=0.27mol。
×0.18mol=0.27mol。
【解析】
铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸完全溶解,得到含有铝离子和铜离子的溶液,如图所示加入氨水,开始没有沉淀,说明硝酸过量,消耗10mL氨水中和过量硝酸,继续加入氨水,开始生产氢氧化铝和氢氧化铜沉淀,当消耗氨水70mL时,沉淀完全,铝离子和铜离子全部转化为氢氧化铝和氢氧化铜沉淀,由于氢氧化铝不与氨水反应,氢氧化铜可溶于氨水,继续加入氨水,部分沉淀开始溶解,当消耗氨水100mL时,氢氧化铜完全溶解,剩余氢氧化铝沉淀,再继续加入氨水,沉淀量不变,据此分析计算解答。
(1)根据分析,图中滴加氨水10~100mL 的过程为铝离子和铜离子全部转化为氢氧化铝和氢氧化铜沉淀,氢氧化铜完全溶解的过程,其中铜元素参与反应的离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2![]() ,Cu(OH)2+4
,Cu(OH)2+4![]() =
=![]() +2OH-+4H2O;
+2OH-+4H2O;
(2)根据反应:H++ NH3·H2O=![]() + H2O,过量的硝酸的物质的量=0.01L×3mol/L=0.03mol,完全根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,Cu2++2NH3·H2O=Cu(OH)2↓+2
+ H2O,过量的硝酸的物质的量=0.01L×3mol/L=0.03mol,完全根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,Cu2++2NH3·H2O=Cu(OH)2↓+2![]() ,8HNO3~3Cu2+~6NH3·H2O,根据Al+4HNO3=Al(NO3)3+NO↑+2H2O, Al3++3NH3·H2O=Al(OH)3↓+3
,8HNO3~3Cu2+~6NH3·H2O,根据Al+4HNO3=Al(NO3)3+NO↑+2H2O, Al3++3NH3·H2O=Al(OH)3↓+3![]() ,8HNO3~2Al3+~6NH3·H2O,则根据上述分析,消耗硝酸与完全沉淀消耗的氨水的物质的量的关系为4HNO3~3NH3·H2O,根据图像沉淀铝离子和铜离子消耗氨水的总物质的量=0.06L×3 mol/L=0.18mol,则反应中消耗的硝酸的物质的量为0.03mol+
,8HNO3~2Al3+~6NH3·H2O,则根据上述分析,消耗硝酸与完全沉淀消耗的氨水的物质的量的关系为4HNO3~3NH3·H2O,根据图像沉淀铝离子和铜离子消耗氨水的总物质的量=0.06L×3 mol/L=0.18mol,则反应中消耗的硝酸的物质的量为0.03mol+![]() ×0.18mol=0.27mol,则100mL该硝酸的浓度=
×0.18mol=0.27mol,则100mL该硝酸的浓度=![]() =2.7mol/L。
=2.7mol/L。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
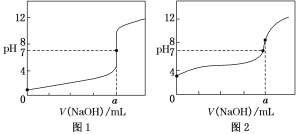
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)