题目内容
【题目】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为__________________ 。
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______,负极的电极反应式为 ____。

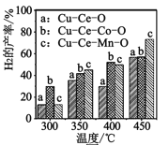
⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2 产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______(选填 a、b、c)及适宜的温度是____ 。
⑷工业中用 CO 和 H2 为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
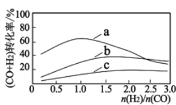
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常数为 K3,则 K3=__________用含 K1、K2 代数式表示)。
⑸已知反应 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2 转化率为 75%,在下图中 画出 CO2 和 CH3OH(g)的浓度随时间变化曲线________。
【答案】3.725×10-6mol·L-1·s-1 化学能转变为电能 CH3OCH3+3H2O-12e-===2CO2+12H+ c 450℃ 1.0 K1/K2 
【解析】
(1)平均反应速率就是反应速率,指单位时间内的浓度变化值,据此计算;
(2)原电池中,负极失去电子,则负极的反应为CH3OCH3→CO2;
(3)氢气的产率随着温度升高在不断升高,a、b、c三种催化剂的催化效率在450°C时,c催化剂产生的氢气产率最高;
(4)根据曲线a,可知在投料比1.0时,CO与H2总转化率最大,由a-b可得到CO(g)+H2O(g)![]() CO2(g)+H2(g),计算其平衡常数;
CO2(g)+H2(g),计算其平衡常数;
(3)根据3min时,氢气的速率,计算出反应消耗的氢气的物质的量浓度,根据反应的方程式和消耗氢气的物质的量浓度,可计算消耗的二氧化碳的浓度,生成甲醇的物质量浓度,达到平衡时,根据二氧化碳的转化率,计算达到平衡时二氧化碳的物质的量浓度,甲醇的物质的量浓度,画出CO2和CH3OH(g)的浓度随时间的变化曲线。
(1)由题干信息可得![]() ,故答案为:3.725×10-6mol·L-1·s-1;
,故答案为:3.725×10-6mol·L-1·s-1;
(2)该装置为燃料电池,将化学能直接转化为电能,原电池中负极失去电子,所以负极电极反应式是CH3OCH3+3H2O-12e-===2CO2+12H+,故答案为:化学能转变为电能;CH3OCH3+3H2O-12e-===2CO2+12H+;
(3)根据图像分析可知,无论用何种催化剂均是温度越高,产率越高,但在450°C,用催化剂c时,H2产率超过70%,具有实际意义,故答案为:c;450℃;
(4)由图像知,a曲线在投料比1.0时,CO与H2总转化率最大;可由反应a-b得到反应CO(g)+H2O(g)![]() CO2(g)+H2(g),平衡常数K3为两者之商=K1/K2,故答案为:1.0;K1/K2;
CO2(g)+H2(g),平衡常数K3为两者之商=K1/K2,故答案为:1.0;K1/K2;
(5)3min时,H2浓度减少0.5mol·L-1·min-1×3min=1.5mol·L-1,则CO2的浓度减少0.5 mol·L-1,此时c(CO2)=0.5 mol·L-1,生成c(CH3OH)=0.5 mol·L-1,达到平衡时,c(CO2)=0.25 mol·L-1,c(CH3OH)=0.75 mol·L-1,画出CO2和CH3OH(g)的浓度随时间的变化曲线为 ,故答案为:
,故答案为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如图该条件下,1molN2和1molO2完全反应生成NO会吸收______kJ能量。

(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请表中数据补充完整:a___________;b___________。
②能验证温度对化学反应速率规律的是实验________![]() 填实验序号
填实验序号![]() 。
。
(3)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) |
|
|
|
|
|
|
①用![]() 表示从0-2s内该反应的平均速率
表示从0-2s内该反应的平均速率![]() ______。
______。
②能说明该反应已达到平衡状态的是______
a.单位时间内消耗nmol![]() 的同时,生成2nmol
的同时,生成2nmol![]()
b.容器内各物质的浓度保持不变
c. 2v逆(NO)=v正(O2)
d.混合气体的总物质的量不随时间的变化而变化






