��Ŀ����
����Ŀ������(N2H4)�ʹ�������(NaH2PO2)������ǿ��ԭ��.�����Ź㷺����;��
(1)��֪:��N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-621.5 kJ��mol-1
��N2O4(l)-=N2(g)+2O2(g) ��H2=+204.3 kJ��mol-1
����ȼ�ϵ�ȼ�շ�ӦΪ2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=_____.
(2)��֪��ӦN2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T��Cʱ,��V L�����ܱ������м���2 mol N2H4(g)��4 mol Cl2(g) ,���Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
N2(g)+4HCl(g),T��Cʱ,��V L�����ܱ������м���2 mol N2H4(g)��4 mol Cl2(g) ,���Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
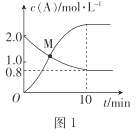
��0~ 10 min��,��N2(g)��ʾ��ƽ����Ӧ����v(N2)=_______��
��M��ʱ,N2H4��ת����Ϊ______(��ȷ��0.1)%��
��T ��Cʱ,�ﵽƽ�������������м���1.2 mol N2H4(g)��0.4 mol Cl2(g)��0. 8 mol N2 (g)��1.2 mol HCl(g) ,��ʱƽ��______(���������ƶ����������ƶ����������ƶ���)��
(3)���ڶ���������,������(P4)��ʯ�����̼������Һһͬ��������黯��Ӧ�����Ƶ�NaH2PO2,ͬʱ����������(PH3)����,�÷�Ӧ�Ļ�ѧ����ʽΪ________________��
�ڴ�����(H3PO2)��һԪ�ᣬ������.1.0 mol��L-1��NaH2PO2��ҺpHΪ8,��������Ka=___________��
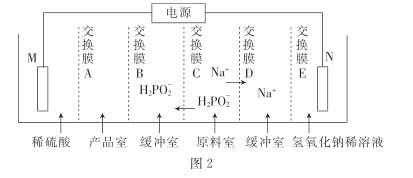
���ô�������ͨ�����������Ʊ�������.װ����ͼ2��ʾ������ĤA����____(������������������������)����Ĥ,�缫N�ĵ缫��ӦʽΪ______,����·������3.8528��105���ص���ʱ.�Ƶô���������ʵ���Ϊ_____ (һ�����ӵĵ���Ϊ 1.6��10- 19����,NA��ֵԼΪ6. 02�� 1023)��
���𰸡�-1038.7kJmol-1 0.06mol/(Lmin) 33.3 �����ƶ� 2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3��+3CaCO3 1.0��10-2 ������ 2H2O+2e-=H2��+2OH- 4mol
��������
(1)���ݸ�˹���ɣ���Ӧ����2+�ڼ��ɵû��ȼ�ϵ�ȼ�շ�Ӧ2N2H4(1)+N2O4(l)===3N2(g)+4H2O(g)��H=(-621.5��2+204.3)kJmol-1=-1038.7kJmol-1��
(2)����ͼʾ��Cl2��Ϊ��Ӧ��Ũ�����С��HCl��Ϊ������Ũ��������
�١�c(Cl2)=(2-0.8)mol/L=1.2mol/L��v(Cl2)=![]() =0.12mol/(Lmin)�����ݷ�Ӧ���������ϵ�������ȿɵ�v(N2)=
=0.12mol/(Lmin)�����ݷ�Ӧ���������ϵ�������ȿɵ�v(N2)=![]() v(Cl2)=0.06mol/(Lmin)��
v(Cl2)=0.06mol/(Lmin)��
�ھ�ͼ��֪��Ӧ��ʼʱc(Cl2)=2mol/L��Ͷ��Ϊ2 mol N2H4(g)��4 mol Cl2(g) ����ʼʱc(N2H4)=1mol/L���������Ϊ2L����M�� N2H4��ת����Ϊx mol/L��������ʽ��

M��Cl2��HCl��Ũ����ȣ���2-2x=4x���x=![]() mol/L����N2H4��ת����Ϊ
mol/L����N2H4��ת����Ϊ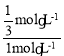 =33.3%��
=33.3%��
�۾�ͼ��֪��Ӧƽ��ʱc(Cl2)=0.8mol/L����ʼc(Cl2)=2mol/L��c(N2H4)=1mol/L������ݷ�Ӧ����ʽN2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g)��֪����Ӧ������c(Cl2)=1.2mol/L������c(N2H4)=0.6mol/L������c(N2)=0.6mol/L��c(HCl)=2.4mol/L������ƽ��ʱ�����ʵ�Ũ��Ϊc(Cl2)=0.8mol/L��c(N2H4)=0.4mol/L��c(N2)=0.6mol/L��c(HCl)=2.4mol/L������¶��µ�ƽ�ⳣ��K=
N2(g)+4HCl(g)��֪����Ӧ������c(Cl2)=1.2mol/L������c(N2H4)=0.6mol/L������c(N2)=0.6mol/L��c(HCl)=2.4mol/L������ƽ��ʱ�����ʵ�Ũ��Ϊc(Cl2)=0.8mol/L��c(N2H4)=0.4mol/L��c(N2)=0.6mol/L��c(HCl)=2.4mol/L������¶��µ�ƽ�ⳣ��K=![]() =77.76��
=77.76��
ƽ�������������м���1.2molN2H4(g)��0.4 mol Cl2(g)��0.8molN2(g)��1.2molHCl(g)�������ʵ�Ũ�ȱ�Ϊc(Cl2)=1mol/L��c(N2H4)=1mol/L��c(N2)=1mol/L��c(HCl)=3mol/L����ʱQc=![]() =81>K������ƽ�������ƶ���
=81>K������ƽ�������ƶ���
(3)�ٸ÷�Ӧ�з�Ӧ����P4��Ca(OH)2��Na2CO3�ȡ���������NaH2PO2��PH3�ȣ��ݴ˿�֪�÷�Ӧ��PԪ�ػ��ϼۼ������ֽ��ͣ������绯������1�ۣ�����3�ۣ���NaH2PO2��PH3��ϵ����Ϊ3��1���ٽ��Ԫ���غ��֪����ʽΪ��2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3��+3CaCO3��
�ڴ�����(H3PO2)��һԪ�ᣬ1.0molL-1�� NaH2PO2��Һˮ�ⷽ��ʽΪ��H2PO2-+H2O=H3PO2+OH-��pH=8����c(H+)=10![]() =1.0��10-2��
=1.0��10-2��
�۸���ͼʾ��֪����Ʒ�Ҳ��������ᣬ��缫MӦΪ�������ˮ�е�OH-��ʣ��H+ͨ������ĤA�����Ʒ�ң����Խ���ĤAΪ�����ӽ���Ĥ���缫NΪ�������H+���缫N�ĵ缫��ӦʽΪ2H2O+2e-=H2��+2OH-����·������3.8528��105���ص���ʱ��ת�Ƶĵ��ӵ����ʵ���Ϊ![]() =4mol�����������һ������ɣ������Ӵ�һ������ɣ����Ե�������ת��1mol��������1mol�����ᣬ��ת��4mol����ʱ����4mol�����ᡣ
=4mol�����������һ������ɣ������Ӵ�һ������ɣ����Ե�������ת��1mol��������1mol�����ᣬ��ת��4mol����ʱ����4mol�����ᡣ

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�����Ŀ������β���к���CO��NO���к����塣
(1)����β����NO���ɹ��̵������仯ʾ��ͼ��ͼ�������£�1molN2��1molO2��ȫ��Ӧ����NO������______kJ������

(2)һ�����ʹ�����ʹNO��CO������Ӧ��2NO+2CO2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t(��) | NO��ʼŨ��(mol/L) | CO��ʼŨ��(mol/L) | �����ıȱ����(m2/g) |
�� | 280 | 1.2��10-3 | 5.80��10-3 | 82 |
�� | 280 | 1.2��10-3 | b | 124 |
�� | 350 | a | 5.80��10-3 | 82 |
����������ݲ���������a___________��b___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��________![]() ��ʵ�����
��ʵ�����![]() ��
��
(3)��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� |
|
|
|
|
|
|
����![]() ��ʾ��0-2s�ڸ÷�Ӧ��ƽ������
��ʾ��0-2s�ڸ÷�Ӧ��ƽ������![]() ______��
______��
����˵���÷�Ӧ�Ѵﵽƽ��״̬����______
a.��λʱ��������nmol![]() ��ͬʱ������2nmol
��ͬʱ������2nmol![]()
b.�����ڸ����ʵ�Ũ�ȱ��ֲ���
c. 2v��(NO)=v��(O2)
d���������������ʵ�������ʱ��ı仯���仯
����Ŀ��2019��ŵ������ѧ����������ӵ�صķ����ߣ�LiFePO4������ӵ�ص��������ϡ��ú�﮷�������Ҫ����Ԫ�صĺ�����Li 8.50%��Ni 6.55%��Mg 13.24%���Ʊ�Li2C2O4���������Ʊ�LiFePO4���ֹ���������ͼ�������̿������ˮ������Ⱦ����
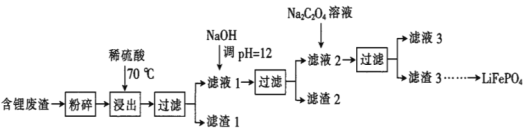
��֪����Һ1����Һ2�в������ӵ�Ũ�ȣ�g��L-1����
Li+ | Ni2+ | Mg2+ | |
��Һ1 | 22.72 | 20.68 | 60.18 |
��Һ2 | 21.94 | 7.7��10-3 | 0.78��10-3 |
I.�Ʊ�Li2C2O4
(1)����2����Ҫ�ɷ���__���ѧʽ����
(2)Na2C2O4��Һ�и����ӵ�Ũ���ɴ�С˳��Ϊ__��
(3)д������Na2C2O4��Һʱ������Ӧ�����ӷ���ʽ��__��
��.�Ʊ�LiFePO4
(4)����ؼ�Li2C2O4��FePO4���ڸ����·�Ӧ����LiFePO4��һ���������壬�÷�Ӧ�Ļ�ѧ����ʽ��___��
(5)LiFePO4��Ҫ�ڸ����³��ͺ������Ϊ�缫�����³���ʱҪ��������ʯī����ʯī��������__����дһ�㣩��
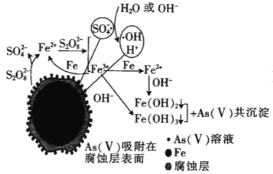
(6)�ҹ���ѧ���о��������������ƣ�Na2S2O8��ȥ����ˮ�е�As(��)�������ģ����ͼ�������������������Ʒ�Ӧ�����ӷ���ʽ��__���ڸ�ģ���еõ������鹲�����ᆳ���գ���Ԫ�ػ��ϼ۱仯����õ�һ�ִ��Ի������ѧʽΪFe7As2O14���������ж��������������ĸ�����Ϊ__��