题目内容
6. 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A. | 由图中信息可知 HA为强酸,N点为恰好中和 | |
| B. | 常温下一定浓度的 MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
分析 A.根据图象可知,0.5mol•L-1HA溶液中pH=2,说明HA为弱酸,N点的pH=7,而两溶液恰好反应时生成强碱弱酸盐,溶液显示碱性;
B.HA为弱酸,则MA为为强碱弱酸盐,溶液的pH>7;
C.K点时MOH的物质的量是HA的2倍,混合液显示碱性,则:c(OH-)>c(H+),氢氧根离子来自A-部分水解,则c(OH-)>c(A-);
D.K点时氢氧根离子浓度大于>$\frac{0.5mol/L×(0.1L-0.05L)}{0.15L}$=$\frac{0.5}{3}$mol/L>0.1mol/L,则溶液的pH>13;根据物料守恒可知:c(HA)+c(A-)=$\frac{0.5mol/L×0.05L}{0.15L}$=$\frac{0.5}{3}$mol/L.
解答 解:A.根据图象可知,0.5mol•L-1HA溶液中pH=2,则HA在溶液中部分电离,故HA为弱酸;当HA与MOH恰好反应时生成强碱弱酸盐MA,溶液呈碱性,pH>7,而N点的pH=7,说明HA有剩余,故A错误;
B.根据A的分析可知,HA为弱酸,MA属于强碱弱酸盐,M+部分水解,溶液呈碱性,故B错误;
C.在K点时MOH的物质的量是HA的2倍,则混合液显示碱性:c(OH-)>c(H+),由于氢氧根离子来自A-部分水解,则c(OH-)>c(A-),溶液中各离子浓度大小为:c(M+)>c(OH-)>c(A-)>c(H+),故C正确;
D.K点时氢氧根离子浓度大于>$\frac{0.5mol/L×(0.1L-0.05L)}{0.15L}$=$\frac{0.5}{3}$mol/L>0.1mol/L,则溶液的pH>13;根据物料守恒可得:n(HA)+n(A-)=0.5mol/L×0.05L=0.025mol,则:c(HA)+c(A-)=$\frac{0.025mol}{0.15L}$=$\frac{0.5}{3}$mol/L,故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度定性比较,题目难度中等,根据图象判断HA为弱酸为解答关键,注意掌握酸碱混合的定性判断及溶液pH的计算方法,D为易错点,注意混合液体积为0.15L,不是0.1L.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| A. | 将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率 | |
| B. | 铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应” | |
| D. | 大量使用含磷洗涤剂,可导致水体富营养化 |
| A. | 镀锌铁皮在食盐水中发生析氢腐蚀 | |
| B. | 电解池的阴极材料一定比阳极材料活泼 | |
| C. | 将铁器与电源正极相连,可在其表面镀锌 | |
| D. | 原电池的负极和电解池的阳极均发生氧化反应 |
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| A. | 金刚石和石墨 | B. | 水晶和石英 | C. | 红磷和白磷 | D. | C60和金刚石 |

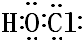 .
.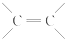 结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(
结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(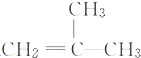 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.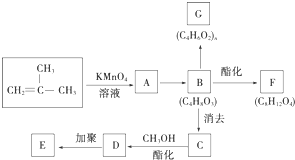
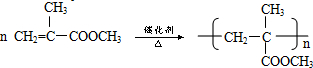
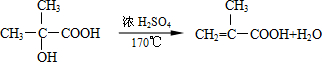 B→G的反应类型:缩聚,G的结构简式:
B→G的反应类型:缩聚,G的结构简式: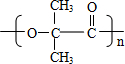 .
.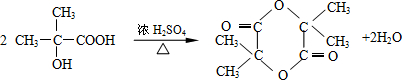 ,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为
,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为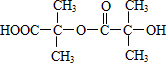 .
. .
.