题目内容
16.化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是( )| A. | 将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率 | |
| B. | 铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应” | |
| D. | 大量使用含磷洗涤剂,可导致水体富营养化 |
分析 A、草木灰和硫铵混合使用,会发生双水解反应,产生氨气;
B、根据铝元素对人体的危害来回答;
C、氟利昂导致臭氧空洞;
D、根据水体富营养化的原因来回答判断.
解答 解:A、将草木灰和硫铵混合使用,会发生双水解反应,产生氨气,降低肥料利用率,故A错误;
B、铝元素对人体有危害,铝制容器不能长期盛装酸性或碱性食品,也不可以用于长期腌制食品,故B错误;
C、氟利昂导致臭氧空洞,二氧化碳是导致温室效应的气体,故C错误;
D、大量使用含磷洗涤剂,可导致水体富营养化和赤潮等现象,故D正确.
故选D.
点评 本题涉及铵盐、金属铝的性质以及常见生活环境的污染和治理知识,属于综合知识的考查,难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
13.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH).下列说法正确的是( )
| A. | 该电池Zn为负极,ZnO为正极,MnO2为催化剂 | |
| B. | 导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn | |
| C. | 该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH- | |
| D. | 电池工作时正极发生氧化反应 |
7.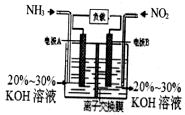 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
1.如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g)?2SO3(g);△H<0反应速率的变化情况(v′表示正反应速率,v″表示逆反应速率).下列说法中正确的是( )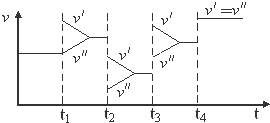

| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
5.钛及其合金具有许多优异的性能.具有超导特性、形状记忆和吸氧特性等,而被称为“太空金属”和“海洋金属”,在航空航天、海洋开发、化工、冶金、汽车等领域有着越来越广泛的用途.
(1)Ti(BH4)2是一种过渡元素硼氢化物材料,基态钛原子外围电子构型为3d24s2;在Ti(BH4)2中钛元素化合价为+2,与Ti(BH4)2中的阴离子互为等电子体CH4.(写一种即可)
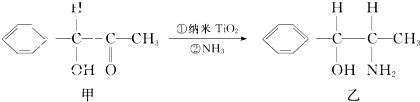
(2)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示,化合物甲的分子中采取sp2方式杂化的碳原子数为7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为C<O<N.
(3)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如表:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序是为CaO>NaCl>KCl.
(4)Ti3+可形成配位数为6的配合物,现有钛的两种颜色的配合物,一种为紫色,另一种为绿色.相关实验证明,两种晶体的组成皆为TiCl3•6H2O.为测定这两种配合物的成键情况,
设计了如下实验:分别取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀;测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的$\frac{2}{3}$.则原绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
(5)有一种氮化钛晶体的晶胞和氯化钠晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为apm,则该氧化钛的密度为$\frac{62×4}{(2a×1{0}^{-10})^{3}{N}_{A}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.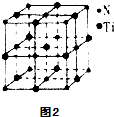
(1)Ti(BH4)2是一种过渡元素硼氢化物材料,基态钛原子外围电子构型为3d24s2;在Ti(BH4)2中钛元素化合价为+2,与Ti(BH4)2中的阴离子互为等电子体CH4.(写一种即可)
(2)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示,化合物甲的分子中采取sp2方式杂化的碳原子数为7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为C<O<N.

(3)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |
(4)Ti3+可形成配位数为6的配合物,现有钛的两种颜色的配合物,一种为紫色,另一种为绿色.相关实验证明,两种晶体的组成皆为TiCl3•6H2O.为测定这两种配合物的成键情况,
设计了如下实验:分别取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀;测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的$\frac{2}{3}$.则原绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
(5)有一种氮化钛晶体的晶胞和氯化钠晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为apm,则该氧化钛的密度为$\frac{62×4}{(2a×1{0}^{-10})^{3}{N}_{A}}$g/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.

6.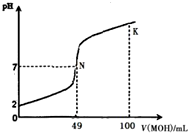 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A. | 由图中信息可知 HA为强酸,N点为恰好中和 | |
| B. | 常温下一定浓度的 MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.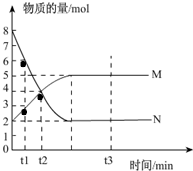 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: