��Ŀ����
1�����ſ�ѧ�����Ľ��������仯������о�Խ��Խ���ˣ���1���������̿��Դٽ���ѧ��ҵ�ķ�չ�������ƻ�����
�������йػ��������˵���������b���������ĸ����
a��������SO2Ũ�ȹ�����غ���ϵͳ������Ѫ�ܼ���
b��SO2��NOx��CO2�Ĵ����ŷŶ����������
c�������������̼�⻯��������ŷſ��������⻯ѧ����
d�����������������ȼú��������̼���á����ܸ��ƿ�������
�ڷ��糧������SO2β���еĿ�ֱ���ð�ˮ���գ����Ϊ��������15L 2.0mol•L-1��ˮ�������4480L��10%��SO2����β�����������������ɱ�״��������ַ�Ӧ������Һ�е�����Ϊ��NH4��2SO3��NH4HSO3��
�����÷��糧������SO2�Ƴ���ˮΪ����ʵ�SO2���ӽ���Ĥȼ�ϵ�أ��õ�ص綯��Ϊ1.06V����ع���ʱ������ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
��2�������糧������SO2ͨ�뺬��Na2S��Na2CO3�ķ�Һ�п��Ƶ�Na2S2O3•5H2O�������е������ǣ�ͨ��һ��ʱ��������岢���������������������ࣻ���������ٲ��γ���Һ��ֹͣͨSO2�����˺�ĸҺ������Ũ������ȴ��Na2S2O•5H2O���壨��ʾ��S+SO32-=S2O32-����������������������ʱ������������ԭ��Ӧ�Ļ�ѧ����ʽΪ��2H2S+SO2=3S��+2H2O�����ڷ�Һ��Na2S��Na2CO3�����ʵ���֮��Ϊ2��1��ʱ����ǡ����ȫ��Ӧ����Na2S2O3.5H2O��
���� ��1����a������������ǿ�̼�����ζ���ж����壻
b��������̼���ŷŲ����γ����ꣻ
c�����������һ����̼��̼�⻯����ȷ�����ǿ�ҵ��չ������£���Щ�ŷ�����⻯��Ӧ�����ɶ�����Ⱦ�����һ��dz��ɫ���д̼��Ե�����Ϊ�⻯ѧ������
d����������̼���á�������ٻ�ʯȼ�ϵ�ʹ�ã����������Դ�����������������ȼú����������β�����������ɼ�����Ⱦ��������ŷţ�
�ڼ���һˮ�ϰ��Ͷ����������ʵ�������ϻ�ѧ����ʽ������ϵSO2+2NH3•H2O=��NH4��2SO3+H2O��SO2+NH3•H2O=NH4HSO3�������жϲ��
������ԭ��ظ�������������Ӧ��������������Ԫ�ػ��ϼ����ߣ�ʧȥ���ӷ���������Ӧ������������ԭ��Ӧ�����Ԫ�ػ��ϼ۱仯�����жϣ�
��2���䷴Ӧԭ��ΪSO2+Na2S+H2O=H2S+Na2SO3��2H2S+SO2=3S��+2H2O������3SO2+2Na2S=3S��+2Na2SO3��
��������Na2S2O3������ǿ�ᷴӦ������dz��ɫ�����������ԭ��ΪNa2S2O3+SO2+H2O=S��+2NaHSO3��
3SO2+2Na2S=3S��+2Na2SO3��
SO2+Na2CO3=Na2SO3+CO2��
Na2SO3+S=Na2S2O3��
��+��+�ۡ�3��4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2��
��� �⣺��1����a������������ǿ�̼�����ζ���ж����壬������SO2Ũ�ȹ�����غ���ϵͳ������Ѫ�ܼ�������a��ȷ��
b��SO2��NOx�ŷ��γ����꣬������̼���ŷŲ����γ����꣬��b����
c�����������һ����̼��̼�⻯����ȷ�����ǿ�ҵ��չ������£���Щ�ŷ�����⻯��Ӧ�����ɶ�����Ⱦ�����һ��dz��ɫ���д̼��Ե�����Ϊ�⻯ѧ��������C��ȷ��
d����������̼���á�������ٻ�ʯȼ�ϵ�ʹ�ã����������Դ�����ٶԻ�ʯ��Դ�����������������������ȼú����������β�����������ɼ�����Ⱦ��������ŷţ�����߿�����������D��ȷ��
�ʴ�Ϊ��b��
������15L 2.0mol•L-1��ˮ�������4480L��10%��SO2����β�����������������ɱ�״������
n��NH3•H2O��=15L��2.0mol/L=30mol��n��SO2��=$\frac{4480L}{22.4L/mol}$��10%=20mol
SO2+2NH3•H2O=��NH4��2SO3+H2O
SO2+NH3•H2O=NH4HSO3��
1��2��n��SO2����n��NH3•H2O��=20��30=2��3��1��1
��ַ�Ӧ������Һ�е�����Ϊ��NH4��2SO3��NH4HSO3��
�ʴ�Ϊ����NH4��2SO3��NH4HSO3��
��ԭ��ط�Ӧ�Ǹ�������������Ӧ������������ԭ��Ӧ������Ԫ�ػ��ϼ۱仯��֪��������������Ԫ�ػ��ϼ����ߣ�ʧȥ���ӷ���������Ӧ�������У���SO2ͨ���صĸ������缫��ӦΪ��SO2+2H2O-2e-=SO42-+4H+�������������õ�������ˮ����缫����Ϊ��O2+4H++4e-=2H2O��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��2���䷴Ӧԭ��ΪSO2+Na2S+H2O=H2S+Na2SO3��2H2S+SO2=3S��+2H2O������3SO2+2Na2S=3S��+2Na2SO3��
��������Na2S2O3������ǿ�ᷴӦ������dz��ɫ�����������ԭ��ΪNa2S2O3+SO2+H2O=S��+2NaHSO3��
3SO2+2Na2S=3S��+2Na2SO3��
SO2+Na2CO3=Na2SO3+CO2��
Na2SO3+S=Na2S2O3��
��+��+�ۡ�3��4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2��
����Na2S��Na2CO3�����ʵ���֮��Ϊ2��1��
�ʴ�Ϊ��2H2S+SO2=3S��+2H2O��2��1��
���� ���⿼���������Ʊ�ʵ�鷽����ԭ���ԭ���ķ����жϣ���Ҫ���������ʣ���ѧ����ʽ��д�����������жϷ�Ӧ����ķ�����Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

| A�� | MgO����ұ������þ | B�� | NaCl�����ƴ��� | ||
| C�� | Cu��OH��2���ڼ������� | D�� | FeCl3���ھ�ˮ |
| A�� | ԭ�Ӱ뾶�ɴ�С��˳����Z��W��Y��X | |
| B�� | Ԫ�صķǽ�����W��Y��X | |
| C�� | Z2Y3��WX�ֱ������ӻ�������ۻ����� | |
| D�� | X��Z��W����������ﶼ������������ |
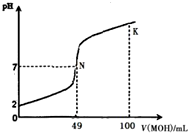 ����к͵ζ���������Ķ���������ѧʵ�飮�����£���50mL 0.5mol•L-1 HA��Һ����μ���0.5mol•L-1ǿ�� MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ�������������ȷ���ǣ�������
����к͵ζ���������Ķ���������ѧʵ�飮�����£���50mL 0.5mol•L-1 HA��Һ����μ���0.5mol•L-1ǿ�� MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ�������������ȷ���ǣ�������| A�� | ��ͼ����Ϣ��֪ HAΪǿ�ᣬN��Ϊǡ���к� | |
| B�� | ������һ��Ũ�ȵ� MAϡ��Һ��pH��7 | |
| C�� | K������Ӧ����Һ������Ũ�ȵĴ�С��ϵ��c��M+����c��OH-����c��A-����c��H+�� | |
| D�� | K���Ӧ����Һ�У���Һ��pH��13��c��HA��+c��A-��=0.25mol•L-1 |
��Ʒ$��_{����1}^{����NaHSO3��Һ}$��Һ$��_{��ȡ}^{��ȩ}$����2�л���$��_{����3}^{��������}$1-�������ѣ�����4����Ʒ
��֪��������ȩ�뱥��NaHSO3��Һ��Ӧ�����ɳ����������ѵķе���34�棬������ˮ����1-�������ܣ���1-�����ķе���118�森�����1��4�ֱ��ǣ�������
| A�� | ��ȡ�����ˡ��������� | B�� | ���ˡ���Һ��������ȡ | ||
| C�� | ���ˡ������ˡ����� | D�� | ���ˡ���Һ�����ˡ����� |
| A�� | ��ϵͳ�������������� ������Ϊ2��6-����-5-�һ����� ������Ϊ2��6-����-5-�һ����� | |
| B�� | ��ϩ�;���ϩ���߶���ʹ������Ȼ�̼��Һ��ɫ | |
| C�� | ������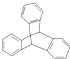 �DZ���ͬϵ�� �DZ���ͬϵ�� | |
| D�� | ������������ķ���ʽΪC3H5N3O9 |
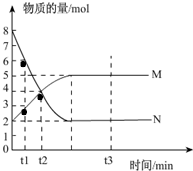 һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN��g��?bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN��g��?bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ�� Ԫ�����ڱ��Т�A��Ԫ�صĵ��ʼ��仯�������;�㷺��
Ԫ�����ڱ��Т�A��Ԫ�صĵ��ʼ��仯�������;�㷺��