题目内容
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N205,装置图如下,下列说法正确的是( )

A. 图中B装置是原电池
B. N2O5在B池的c极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+
C. A装置中通入O2一极的电极反应式为O2+2H2O+4e-=4OH-
D. 若A装置中通入SO2的速率为2.24Lmin-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为14.6mLmin-1
【答案】A
【解析】
A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池
B.与电源的正极相连的电极为阳极,c极与正极相连为阳极,N2O4在阳极失电子生成N2O,电极反应式为:2O4+2HNO3-2e2N2O5+2H+2N2O5+2H
C.通入O2一极是原电池的正极,电极反应式为:O2-4e-+4H+=2H2O
D.电池的总反应式为:2Sの2+2H2O+O2=2H2SO4,1mi内2.24Ln(SO2)=0.1mol,消耗水0.1mol
22. 4L/mol生成硫酸的质量为:0.1molx98g/mol=9.8g,消耗水的质量为:0.1molx18g/mol=1.8g,设1min内通入 c mn LH.2O9.8g则有:9.89+z×1g/mL-18。100%=0.5T =11. 6ml/min

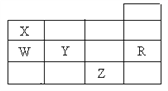
【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。