题目内容
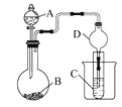
【题目】锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________,样品中S2-的含量为____________(写出表达式与计算过程)。
【答案】BaSO4+4C![]() BaS+4CO↑ 与产生的有毒气体CO反应,防止污染大气 浅蓝色褪去,且半分钟内不再恢复
BaS+4CO↑ 与产生的有毒气体CO反应,防止污染大气 浅蓝色褪去,且半分钟内不再恢复 ![]() ×100%
×100%
【解析】
(1)在回转炉中BaSO4与C在高温下反应产生BaS和CO;
(2)水蒸气与CO反应产生CO2和H2;
(3)利用I2遇淀粉溶液变为蓝色判断滴定终点;先计算出与Na2S2O3反应的过量的I2的物质的量,然后由I2的总物质的量计算出发生反应S2-+I2=S+2I-的I2的物质的量及S2-的物质的量和质量,最后根据质量分数×100%计算S2-的含量。
(1)在回转炉中BaSO4与C在高温下反应产生BaS和CO,根据电子守恒、原子守恒,可得反应的化学方程式为:BaSO4+4C![]() BaS+4CO↑;
BaS+4CO↑;
(2)回转炉尾气中含有有毒气体CO,该气体具有还原性,能够在高温下与水蒸气反应产生无毒的气体CO2和H2,因此可防止污染大气;
(3)碘遇淀粉变蓝色,当滴定达到终点时,碘完全被消耗,溶液由浅蓝色变为无色,且半分钟内不再恢复蓝色;根据方程式I2+2S2O32-=2I-+S4O62-可知与Na2S2O3反应的I2的物质的量n(I2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000 mol/L×V×10-3 L,则与S2-反应的I2的物质的量n(I2)=0.1000 mol/L×25×10-3 L-
×0.1000 mol/L×V×10-3 L,则与S2-反应的I2的物质的量n(I2)=0.1000 mol/L×25×10-3 L-![]() ×0.1000 mol/L×V×10-3 L,根据S2-+I2=S+2I-,可知n(S2-)=n(I2)=0.1000 mol/L×25×10-3 L -
×0.1000 mol/L×V×10-3 L,根据S2-+I2=S+2I-,可知n(S2-)=n(I2)=0.1000 mol/L×25×10-3 L -![]() ×0.1000 mol/L×V×10-3 L,m(S2-)= n(S2-)·M=[0.1000 mol/L×25×10-3 L -
×0.1000 mol/L×V×10-3 L,m(S2-)= n(S2-)·M=[0.1000 mol/L×25×10-3 L -![]() ×0.1000 mol/L×V×10-3 L]×32 g/mol,则S2-的质量分数=
×0.1000 mol/L×V×10-3 L]×32 g/mol,则S2-的质量分数=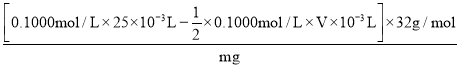 ×100%=
×100%=![]() ×100%。
×100%。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案