题目内容
【题目】热化学碘硫循环可用于大规模制氢气,SO2水溶液还原I2和HI分解均是其中的主要反应。回答下列问题:
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
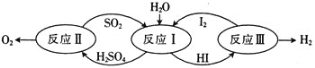
反应II包含两步反应:
①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出反应①自发进行的条件是:________。
②写出反应Ⅱ的热化学方程式:________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
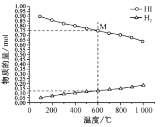
①该反应的△H ________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ___MPa,反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ____(用含k1、k-1、k2…的代数式表示)。
【答案】高温 2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol > 0.0125 ![]() (或0.167) 吸收
(或0.167) 吸收 ![]() c(H2)·c(I2)
c(H2)·c(I2)
【解析】
(1)由反应式①+②可得热化学方程式;
(2)①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应;
②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压![]() ,计算出各组分气体的分压,从而求得平衡常数;
,计算出各组分气体的分压,从而求得平衡常数;
(3)①第一步反应断裂共价键,吸收能量;
②反应速率由慢反应决定,即v=k3c(H2I)c(I),用第一步反应k1c(I2)=k-1c2(I),求出c(I)的表达式,用第二步的反应k2c(I)c(H2)=k-2c(H2I),求出c(H2I)的表达式,代入即可求得v。
(1)①反应①是气体物质的量增大的吸热反应,由![]() ,能自发进行的条件是高温,故答案为:高温;
,能自发进行的条件是高温,故答案为:高温;
②由反应式①+②可得出反应Ⅱ的热化学方程式:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol;故答案为:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol;
(2)①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应,该反应的△H>0,故答案为:>;
②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压![]() p,各气体的平衡分压:
p,各气体的平衡分压:![]() ,
,![]() ,反应HI(g)
,反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数
I2(g)的平衡常数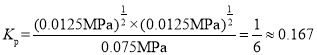 ,故答案为:0.0125;
,故答案为:0.0125;![]() (或0.167);
(或0.167);
(3)①第一步反应断裂共价键,吸收能量,故答案为:吸收;
②反应速率由慢反应决定,即v=k3c(H2I)c(I),
第一步是快速平衡,k1c(I2)=k-1c2(I),可得![]() ,第二步也是快速平衡,k2c(I)c(H2)=k-2c(H2I),可得
,第二步也是快速平衡,k2c(I)c(H2)=k-2c(H2I),可得![]() ,则速率方程为:
,则速率方程为:![]() ,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2020/07/22/00/8fe3223f/SYS202007220000202798657132_DA/SYS202007220000202798657132_DA.002.png" width="49" height="45" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />c(H2)·c(I2)。
,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2020/07/22/00/8fe3223f/SYS202007220000202798657132_DA/SYS202007220000202798657132_DA.002.png" width="49" height="45" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />c(H2)·c(I2)。

 口算题天天练系列答案
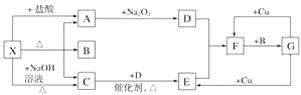
口算题天天练系列答案【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
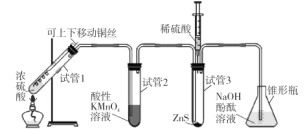
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D
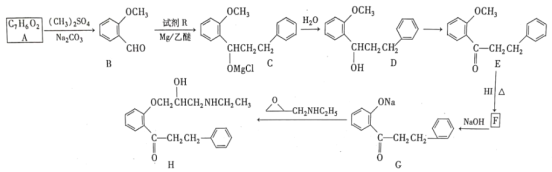
【题目】微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。
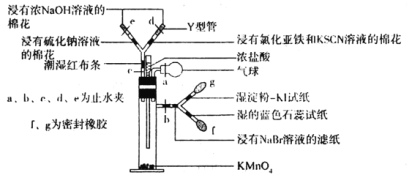
回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________。
(2)加入浓盐酸后试管内发生反应的化学方程式是__________________________________。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:___________
操作步骤 | 实验现象 |
缓慢加入浓盐酸,打开c、d、e,使产生的氯气缓慢充入Y试管 | |
关闭c打开b,使氯气缓慢进入Y管中 |
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是__________________________________________________。
(5)此装置___________(填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是__________________________。