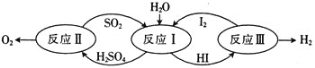
题目内容
【题目】已知:pAg=![]() lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
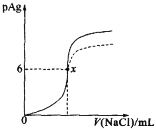
A.原AgNO3溶液的物质的量浓度为1mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1mol·L-1的NaCl换成0.1mol·L-1NaI,则图像在终点后变为虚线部分
【答案】D
【解析】
分析题给信息,纵坐标为Ag+浓度的负对数,则pAg值越大,对应的Ag+浓度就越小。根据Ksp(AgCl)值,结合图给信息,可以计算出x点的坐标。组成类似的难溶电解质,Ksp值越小越难溶。据此进行分析。
A.开始时,pAg=0,则c(Ag+)=1mol/L,原AgNO3溶液的物质的量浓度为1mol·L-1,A项正确;
B.x点的纵坐标为6,说明此时c(Ag+)=10-6mol/L,一般认为溶液中离子浓度小于10-5mol/L即沉淀完全,则AgNO3与NaCl完全反应,![]() ,所以
,所以![]() ,故x点的坐标为(100,6),B项正确;
,故x点的坐标为(100,6),B项正确;
C.x点的纵坐标为6,说明此时c(Ag+)=10-6mol/L,一般认为溶液中离子浓度小于10-5mol/L即沉淀完全。故x点可认为溶液中Ag+被沉淀完全,C项正确;
D.由题给信息可知,与AgCl相比,AgI的Ksp值更小,所以把0.1mol·L-1的NaCl换成0.1mol·L-1NaI,溶液中c(Ag+)要更小,故图像在终点后曲线变化应在实线之上,D项错误;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在2020年抗击新型冠状病毒肺炎中被广泛用于消毒,其有效成分是NaClO。某校化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
已知:①室温下,饱和NaClO溶液pH为11
②25℃时,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8
I.制备NaClO溶液
该学习小组按下图装置进行实验(部分夹持装置省去)
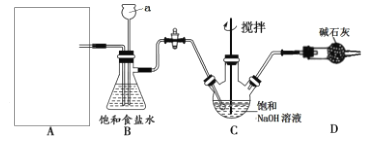
(1)上图中A为实验室制备Cl2的发生装置,可以选用下列图中_(填代号)装置,用该装置制备Cl2反应的化学方程式为__。
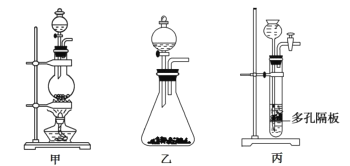
(2)B装置中仪器a的名称是____,B装置可除去氯气中氯化氢杂质, 此外还有______作用(写出一点)。
II.NaClO性质探究
按上图装置进行实验,一段时间后,取C瓶中的溶液进行实验,如下表:
实验内容 | 实验现象 | |
实验l | 取样,滴加紫色石蕊试液 | 变蓝,不褪色 |
实验2 | 测定溶液的pH | 12 |
(3)C瓶溶液中的溶质除NaCl外,还有______(填化学式)。
(4)将C瓶中NaOH溶液换成NaHCO3溶液,反应一段时间后,取C瓶中的溶液按上表实验内容进行实验。现象为:实验l中紫色石蕊试液立即褪色,实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因是________。
III.测定C瓶溶液中NaClO含量(单位:g·L-1)
i.取C瓶溶液10.00mL于锥形瓶中,加入适量硫酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
ii.用0.1000molL-1Na2S2O3标准溶液滴定上述锥形瓶中的溶液至终点,重复操作2~3次,消耗Na2S2O3溶液的平均用量为12.00mL。(已知:I2+2![]() =2I-+
=2I-+![]() )
)
(5)i中主要发生反应的离子方程式为_______,ii中用_______作指示剂。
(6)盖紧瓶塞并在暗处反应的原因是________。
(7)C瓶溶液中NaClO含量是______g·L-1(保留2位小数)。
【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
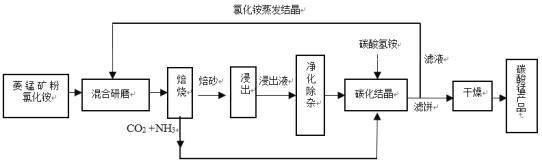
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。