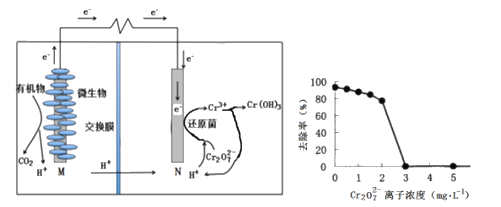
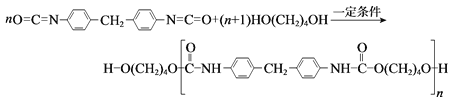
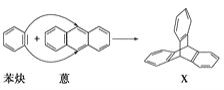
题目内容
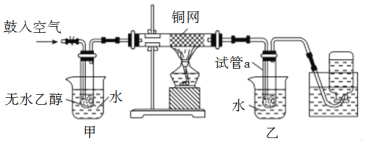
【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
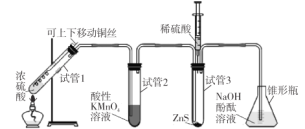
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D
【答案】B
【解析】
试管1中浓硫酸和铜在加热条件下反应生成SO2,生成的SO2进入试管2中与酸性高锰酸钾溶液发生氧化还原反应,使得高锰酸钾溶液褪色,试管3中ZnS与稀硫酸反应生成H2S,2H2S+SO2===3S↓+2H2O,出现淡黄色的硫单质固体,锥形瓶中的NaOH用于吸收SO2,防止污染空气,据此分析解答。
A.如果出现白色固体也应该是硫酸铜固体而不是其晶体,因为硫酸铜晶体是蓝色的,A选项错误;
B.试管2中紫红色溶液由深变浅,直至褪色,说明SO2与酸性高锰酸钾溶液发生氧化还原反应,SO2具有还原性,B选项正确。
C.ZnS与稀硫酸反应生成H2S,2H2S+SO2===3S↓+2H2O,出现硫单质固体,所以现象与解释均不正确,C选项错误;
D.若NaHSO3溶液显酸性,酚酞溶液就会褪色,故不一定是NaHSO3溶液碱性小于NaOH,D选项错误;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂。下图是草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
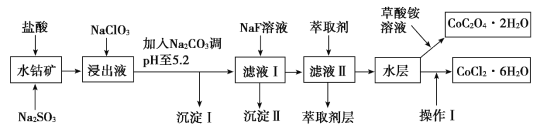
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子方程式为______________。
(2)1molNaClO3在浸出液中发生反应时,转移的电子数为_________。
(3)加入Na2CO3调pH至5.2只得到两种沉淀,则沉淀I的成分为______________(填化学式,下同);萃取剂层含锰元素,则沉淀Ⅱ的主要成分为______________。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3、________、________、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中,不同温度范围内得到一种不同的固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程产生的气体只有水蒸气和CO2,则290~320℃范围内,剩余固体物质的化学式为______________。