题目内容
【题目】2016 年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB 族元素对应离子的萃取,如La3+、Sc2+。写出基态二价 钪离子(Sc2+)的核外电子排布式:____,其中电子占据的轨道数为_____个。

(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____,羟基间的相互作用力为_____。
(3)不同大小苯芳烃能识别某些离子,如:N3-、SCN等。一定条件下,SCN与 MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______。
(4)NH3分子在独立存在时 H-N-H 键角为 106.7°。 [Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,其原因是:_________________________。
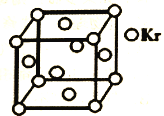
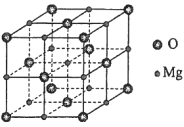
(5)已知 C60 分子结构和 C60 晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个 C60 分子中含有σ键的个数为______,C60 晶体密度的计算式为____gcm3。(NA 为阿伏伽德罗常数 的值)

【答案】1s22s22p63s23p63d1或[Ar]3d1 10 sp3 氢键 N≡C—S—S—C≡N 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故H-N-H键角变大 90 ![]()
【解析】
(1)Sc为21号元素,核外电子排布式为1s22s22p63s23p63d14s2,失去4s能级2个电子形成Sc2+;
(2)羟基中O原子形成2个σ键,含有2对孤电子对,据此分析解答;
(3) N3-和SCN-互为等电子体,根据等电子体的结构相似,分析书写(SCN)2 的结构式;
(4)根据孤电子对与成键电子对之间排斥力大于成键电子对之间的排斥力分析解答;
(5)每个碳原子形成3个σ键,每个σ键为2个碳原子共有,则平均每个碳原子形成1.5个σ键;根据均摊法计算晶胞中C60分子数目,计算晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1)Sc为21号元素,核外电子排布式为1s22s22p63s23p63d14s2,失去4s能级2个电子形成Sc2+,Sc2+核外电子排布式为:1s22s22p63s23p63d1,其中电子占据3个s轨道、6个p轨道、1个d轨道,共占据轨道数目为10个,故答案为:1s22s22p63s23p63d1或[Ar]3d1;10;
(2) 羟基中O原子形成2个σ键,含有2对孤电子对,杂化轨道数目=2+2=4,O原子采用sp3杂化,羟基之间能够形成氢键,故答案为:sp3;氢键;
(3) N3-和SCN-互为等电子体,等电子体的结构相似,SCN-中C原子价层电子对个数是2,为直线形结构,所以N3-为直线形结构; (SCN)2 分子中S-C原子之间为共价单键、C和N原子之间存在共价三键,其结构式为N≡C-S-S-C≡N,故答案为:N≡C-S-S-C≡N;
(4)NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱,故NH3形成配合物后H-N-H键角变大,故答案为:NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱,故H-N-H键角变大;
(5)每个碳原子形成3个σ键,每σ键为2个碳原子共有,则平均每个碳原子形成1.5个σ键,则一个C60分子中含有σ键个数为1.5×60=90,晶胞中C60分子数目=8×![]() +6×
+6×![]() =4,晶胞质量=
=4,晶胞质量=![]() g,晶体密度=
g,晶体密度=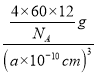 =
=![]() g/cm3=
g/cm3=![]() g/cm3,故答案为:90;
g/cm3,故答案为:90;![]() 。
。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动