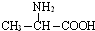题目内容
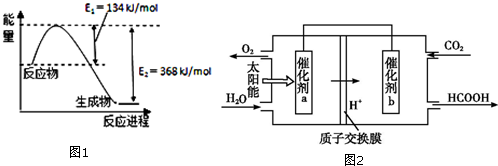
1.随着大气污染的日趋严重,“低碳减排”备受关注,研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)
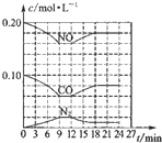
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.
③25℃时,部分物质的电离平衡常数如图所示:
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)
分析 (1)由图1,可得热化学方程式:①.2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=2×[-(368-134)KJ/mol]=-468KJ/mol;
已知:②.N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
③.2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
根据盖斯定律,(③+①-②)可得:2NO(g)+2CO(g)?N2(g)+2CO2(g),焓变也进行相应的计算;
(2)发生反应:2NO(g)+2CO(g)?N2(g)+2CO2
①a.反应前后气体物质的量减小,随反应进行容器内气体压强减小,容器内压强不变,说明到达平衡;
b.增大反应物浓度,平衡正向移动,化学平衡常数只受温度影响;
c.升高温度后,K值减小,说明平衡逆向进行;
d.向该容器内充入He气,总压增大,气体分压不变,所以反应速率不变;
②根据K=c(N2)×c2(CO2)c2(NO)×c2(NO)计算平衡常数,再计算浓度商Qc,与平衡常数比较判断反应进行方向;
(3)①反应中化合价降低的元素只有N元素,其化合价由+4降低为0计算,计算生成氮气的物质的量,进而计算转移电子数目;
②由图可知,左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH;
③电离平衡常数越大,酸性越强,电离平衡常数越小,其对应酸根离子结合H+能力越强,水解程度越大,碱性越强.
解答 解:(1)由图1可得热化学方程式:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=2×[-(368-134)KJ/mol]=-468KJ/mol;
已知:②.N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
③.2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
根据盖斯定律,(③+①-②)可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-112.3kJ/mol-468kJ/mol-112.3=-759.8KJ/mol,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol;
(2)发生反应:2NO(g)+2CO(g)?N2(g)+2CO2,
①a.正反应为气体物质的量减小的反应,随反应进行,容器内压强减小,当容器内的压强不发生变化,说明该反应达到平衡,故a正确;
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,平衡常数只受温度影响,K值不变,故b正确;
c.升高温度后,K值减小,说明平衡逆向进行,NO的转化率减小,故c正确;
d.向该容器内充入He气,总压增大,反应气体分压不变,浓度不变,所以反应反应速率不变,故d错误;故选:abc;
②由图可知,平衡状态下物质的浓度为c(CO)=0.06mol/L,c(NO)=0.16mol/L,c(N2)=0.02mol/L,故平衡时c(CO2)=2c(N2)=0.04mol/L,则该温度下K=c(N2)×c2(CO2)c2(NO)×c2(NO)=0.02×0.0420.162×0.162≈0.0488;
若保持温度不变,此时再向容器中充入CO2、NO各0.060mol,浓度商Qc=0.02×(0.04+0.06)(0.16+0.06)2×0.162≈0.16>K=0.0488,平衡逆向进行,
故答案为:逆向;
(3)①14gN2的物质的量为14g28g/mol=0.5mol,反应中化合价降低的元素只有N元素,其化合价由+4降低为0,故转移电子数目为0.5mol×2×4×6.02×1023mol-1=2.408×1024,
故答案为:2.408×1024;
②由图可知,左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH,电极反应式为:CO2+2H++2e-=HCOOH,
故答案为:CO2+2H++2e-=HCOOH;
③电离平衡常数越大,酸性越强,电离平衡常数越小,其对应酸根离子结合H+能力越强,水解程度越大,碱性越强,故结合H+的能力有强到弱CO32->ClO->HCO3->HCOO-,溶液碱性Na2CO3>NaClO>NaHCO3>HCOONa,pH由小到大的顺序是c<d<b<a,
故答案为:CO32->ClO->HCO3->HCOO-;c<d<b<a.
点评 本题比较综合,涉及热化学方程式书写、化学平衡移动与影响因素、平衡常数影响因素及应用、氧化还原反应计算、电极反应式书写、电离平衡常数应用等,需要学生具备扎实的基础,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案| A. | 生铁属于合金 | |
| B. | 金属的冶炼过程通常是把金属阳离子还原成单质的过程 | |
| C. | 回收废旧金属既可以治理污染,又可以缓解资源短缺 | |
| D. | 工业上电解氧化镁获得金属镁 |
| A. | CH4 | B. | CO2 | C. | H2S | D. | N2 |
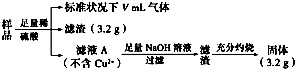
| A. | V=44.8 | |
| B. | 原样品中Fe元素的质量分数为38.89% | |
| C. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| D. | 样品中CuO的质量为4.0 g |
| A. | 1 mol NH2- 含有9 NA个电子 | |
| B. | 1.8 g的NH4+离子中含有的电子总数为NA | |
| C. | 0℃时,44.8L SO3含有的氧原子数为6 NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
| 选项 | 实验操作 | 实验目的或结论 |
| A | C2H5OH浓硫酸170℃共热, 制得气体通入酸性KmnO4溶液 | 检验制得气体是否为乙烯 |
| B | 向含有少量的FeBr2和FeCl2溶液中 加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| C | 在淀粉溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 银氨溶液中滴入少量组成为C2H4O2的液态 有机物,水溶微热,有银镜出现 | 不能确定该有机物一定是甲酸甲酯 |
| A. | A | B. | B | C. | C | D. | D |

 .
.