题目内容
6.下列有关金属或合金的说法中不正确的是( )| A. | 生铁属于合金 | |
| B. | 金属的冶炼过程通常是把金属阳离子还原成单质的过程 | |
| C. | 回收废旧金属既可以治理污染,又可以缓解资源短缺 | |
| D. | 工业上电解氧化镁获得金属镁 |
分析 A.合金是指在一种金属中加热融合其他金属或非金属形成的混合物;
B.金属的冶炼就是指将化合态的金属转变为游离态的金属,也就是将化合物中的金属转变为金属单质;
C.根据回收利用废旧金属的意义进行分析判断;
D.氧化镁熔点很高,工业上电解熔融氯化镁获得金属镁;
解答 解:A.生铁中含有铁与碳,属于合金,故A正确;
B.金属冶炼就是将化合物中的金属转变为金属单质,即把金属阳离子还原成单质的过程,故B正确;
C.回收利用废旧金属不仅可以节约资源,而且可以减少对环境的污染,故C正确;
D.因为MgO的熔点高于MgCl2,因此电解熔融MgCl2更经济,工业上电解氯化镁获得金属镁,故D错误;
故选:D.
点评 本题考查了合金的概念、金属的冶炼等,熟悉概念及金属活泼性与冶炼方法的选择是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.氮化铝(AlN、Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.下列叙述正确的是( )
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | AlN的摩尔质量为41 g | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | 上述反应中,每生成1 mol AlN需转移3 mol电子 |
1.有机物大多易挥发,因此许多有机物保存时为避免挥发损失,可加一层水即“水封”,下列有机物可以用“水封法”保存的是( )
| A. | 己烷 | B. | CHCl3 | C. | 苯酚 | D. | 酒精 |
11.下列关于容量瓶的使用操作中正确的是( )
| A. | 使用容量瓶前应先检查它是否漏水 | |
| B. | 容量瓶先用蒸馏水洗净,再用待配液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2 cm处,再改用胶头滴管滴加蒸馏水至刻度线 | |
| D. | 浓硫酸稀释后马上转移到容量瓶中 |
18.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 a mol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 其他条件不变向上述平衡体系中再充入lmolX,v(正)增大,v(逆)减小,平衡正向移动 |
1.随着大气污染的日趋严重,“低碳减排”备受关注,研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
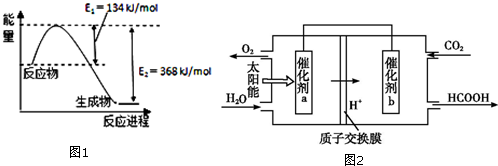
(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)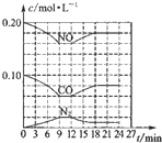
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.
③25℃时,部分物质的电离平衡常数如图所示:
请回答下列问题:
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)
(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)

a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.

③25℃时,部分物质的电离平衡常数如图所示:
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)