题目内容
10.下列实验操作与预期的目的或所得实验结论一致的是( )| 选项 | 实验操作 | 实验目的或结论 |
| A | C2H5OH浓硫酸170℃共热, 制得气体通入酸性KmnO4溶液 | 检验制得气体是否为乙烯 |
| B | 向含有少量的FeBr2和FeCl2溶液中 加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| C | 在淀粉溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 银氨溶液中滴入少量组成为C2H4O2的液态 有机物,水溶微热,有银镜出现 | 不能确定该有机物一定是甲酸甲酯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇与酸性高锰酸钾溶液反应;
B.加入氯水,亚铁离子被氧化;
C.淀粉遇碘单质变蓝色;
D.有银镜出现,一定含-CHO,可能为HOCH2CHO.
解答 解:A.乙醇易挥发,能是酸性高锰酸钾溶液褪色,不能检验是否生成乙烯,故A错误;
B.加入氯水,亚铁离子被氧化,不能只用氯水除去FeCl2溶液中的FeBr2,反应后还应加入足量铁粉,故B错误;
C.淀粉遇碘单质变蓝色,而食盐中添加碘酸钾,故C错误;
D.银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现,一定含-CHO,可能为HOCH2CHO或甲酸甲酯,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及物质的鉴别、除杂等,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
1.随着大气污染的日趋严重,“低碳减排”备受关注,研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
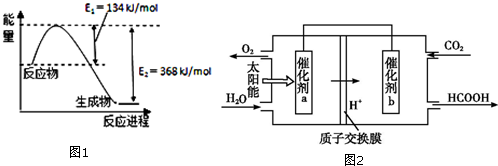
(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)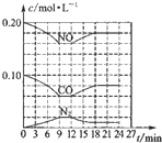
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.
③25℃时,部分物质的电离平衡常数如图所示:
请回答下列问题:
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)
(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)

a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.

③25℃时,部分物质的电离平衡常数如图所示:
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)
5.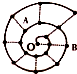 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )| A. | 同一虚线相连的元素离O点越远的原子半径越大 | |
| B. | A、B处于同一周期 | |
| C. | A元素是图中非金属性最强的元素 | |
| D. | A、B组成的化合物中不可能含有共价键 |
2.美媒称,中国即将批量生产更为优秀的航空发动机,新生动机将适应更高的内部温度,拥有更出色的性能,很可能被安装在作战飞机上,这表明中国工程师已掌握可制造镍基含铼单晶合金叶片的技术.查资料发现:铼(Re)的熔点3180℃,沸点5627℃;纯铼质软,有良好的机械性能;自然界有2种铼原子 ${\;}_{75}^{185}$Re、${\;}_{75}^{187}$Re,下列说法中正确的是( )
| A. | 镍基含铼单晶合金属于金属晶体 | |
| B. | ${\;}_{75}^{185}$Re和 ${\;}_{75}^{187}$Re互称为核素 | |
| C. | 铼(Re)元素的相对原子质量为186 | |
| D. | 含铼合金比纯铼的熔点高、硬度大 |
20.从化学视角观察和分析,下列说法正确的是( )
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | “低碳”是指采用含碳量低的烃类作为燃料 | |
| C. | 银质物品久置在空气中表面变黑,是电化学腐蚀引起的 | |
| D. | 皮肤、指甲不慎沾上浓硝酸,会发生颜色反应而变黄色 |