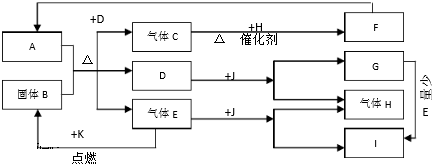
题目内容
7.根据如图所示回答有关问题:
(1)甲池电解池(选填原电池或电解池),石墨A上发生的电极反应式为:2Cl--2e-=Cl2↑.
(2)乙池中Zn棒为负极,Cu棒上发生还原反应(选填氧化或还原),Zn棒上反生反应的电极反应式为:Zn-2e-=Zn2+.
(3)石墨B上刚好有9.6g物质析出时,则反应过程中转移的电子数为0.3mol.
分析 乙池为原电池,Zn棒逐渐溶解,应为原电池负极,发生氧化反应,Cu棒为正极,发生还原反应生成铜,与铜棒相连的为电解池的阳极,发生氧化反应,与锌相连的电极为电解池的阴极,发生还原反应,以此解答该题.
解答 解:(1)甲为电解池,A连接铜棒,为电解池的氧气,发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,故答案为:电解池;2Cl--2e-=Cl2↑;
(2)乙池中Zn棒为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,Cu棒为正极,发生还原反应,
故答案为:负;还原;Zn-2e-=Zn2+;
(3)石墨B上刚好有9.6g物质析出,n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,由电极方程式Cu2++2e-═Cu可知转移电子数为0.3mol,
故答案为:0.3mol.
点评 本题考查原电池和电解池知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握原电池和电解池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
18.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 a mol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 其他条件不变向上述平衡体系中再充入lmolX,v(正)增大,v(逆)减小,平衡正向移动 |
2.下列关于蒸发皿的使用操作正确的是( )
| A. | 用酒精灯火焰的外焰部分直接加热蒸发皿底部 | |
| B. | 蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干 | |
| C. | 将热的蒸发皿用手拿离火焰,放在实验台上 | |
| D. | 将灼热的蒸发皿直接放在冰水中冲洗 |
1.随着大气污染的日趋严重,“低碳减排”备受关注,研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)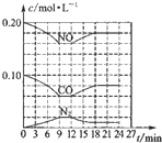
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.
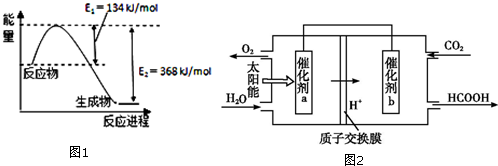
③25℃时,部分物质的电离平衡常数如图所示:
请回答下列问题:
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)
(1)图1是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图.已知:
N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO(g)与CO反应生成无污染气体的化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
(2)将0.20molNO和0.10molCO充入一个容积恒定为1L的密闭容器中发生如图所示的反应,反应达到平衡时,生成了0.02molCO2.
①下列说法正确的是abc.(填序号)

a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K不变
c.升高温度后,K值减小,NO的转化率减小
d.向该容器内充入He气,压强增大,反应速率增大
②反应达到平衡时,若保存温度不变,此时再向容器中充入CO2、NO各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”)
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4+2NO2=N2+CO2+2H2O,当生成14gN2时,转移电子数目是2.408×1024
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.如图2是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.

③25℃时,部分物质的电离平衡常数如图所示:
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
同浓度的HCOO-、HCO3-、CO32-、ClO-结合H+的能力有强到弱的顺序是CO32->ClO->HCO3->HCOO-,物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a、Na2CO3;b、NaClO;c、HCOONa;d、NaHCO3,pH由小到大的顺序是c<d<b<a(填编号)
2.美媒称,中国即将批量生产更为优秀的航空发动机,新生动机将适应更高的内部温度,拥有更出色的性能,很可能被安装在作战飞机上,这表明中国工程师已掌握可制造镍基含铼单晶合金叶片的技术.查资料发现:铼(Re)的熔点3180℃,沸点5627℃;纯铼质软,有良好的机械性能;自然界有2种铼原子 ${\;}_{75}^{185}$Re、${\;}_{75}^{187}$Re,下列说法中正确的是( )
| A. | 镍基含铼单晶合金属于金属晶体 | |
| B. | ${\;}_{75}^{185}$Re和 ${\;}_{75}^{187}$Re互称为核素 | |
| C. | 铼(Re)元素的相对原子质量为186 | |
| D. | 含铼合金比纯铼的熔点高、硬度大 |