��Ŀ����
����Ŀ��Ϊ��ʵ����ˮ��������ij�������ۺϴ�����![]() ��ˮ��ҵ����(��Ҫ��N2��CO2��SO2��NO��CO�������������ɷ�)��������������̣�
��ˮ��ҵ����(��Ҫ��N2��CO2��SO2��NO��CO�������������ɷ�)��������������̣�
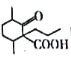
��֪��1 mol CO��1 mol CH3OH�ֱ���ȫȼ������CO2(g)��H2O(l)���ų�������Ϊ283.0kJ��726.5kJ������˵���������
A.����1����Ҫ����Ca(OH)2��CaCO3��CaSO3
B.����X�����������ֻ�ԭ��
C.��ͬ������CO��CH3OH��ȫȼ�գ����߷ų���������
D.������![]() ��ˮʱ��������Ӧ�����ӷ���ʽΪ��
��ˮʱ��������Ӧ�����ӷ���ʽΪ��![]() +
+![]() ��N2��+2H2O
��N2��+2H2O
���𰸡�B
��������
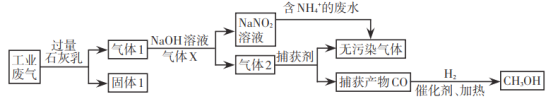
������ͼ��֪����ҵ������CO2��SO2�ɱ�ʯ�������գ����ɹ���1ΪCaCO3��CaSO3������1�Dz��ܱ�����ʯ�������յ�N2��NO��CO������1ͨ������X��������������Һ������NaNO2��X��Ϊ������������Ŀ���ǽ�һ����������Ϊ����������һ����������Ϊ��������������������Һ��Ӧ����NaNO2��NaNO2�뺬��NH4+����Һ��Ӧ��������Ⱦ����ĵ�����������2����CO��N2���ò��������CO���壬���������£�һ����̼���������ȷ�Ӧ���ɼ״���
A. ��ҵ������CO2��SO2�ɱ�ʯ�������գ�����CaCO3��CaSO3�����������ƹ����������1Ϊ��Ҫ����Ca��OH��2��CaCO3��CaSO3����A��ȷ��
B. �ɷ�����֪������1��ͨ�������XΪ������������Ŀ���ǽ�һ����������Ϊ����������һ����������Ϊ��������������������Һ��Ӧ����NaNO2����B����
C. ��ͬ������CO��CH3OH��ȫȼ�շų��������ֱ�Ϊ![]() kJ��
kJ��![]() kJ������߷ų��������࣬��C��ȷ��
kJ������߷ų��������࣬��C��ȷ��
D.�ɷ�����֪��NaNO2���ˮ��NH4+����������ԭ��Ӧ��������Ⱦ�ĵ�����ˮ����Ӧ�����ӷ���ʽΪNH4++NO2-=N2��+2H2O����D��ȷ��
��ѡB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��2019��ŵ������ѧ����������ӵ�صķ����ߣ�LiFePO4������ӵ�ص��������ϡ��ú�﮷�������Ҫ����Ԫ�صĺ�����Li 8.50%��Ni 6.55%��Mg 13.24%���Ʊ�Li2C2O4���������Ʊ�LiFePO4���ֹ���������ͼ�������̿������ˮ������Ⱦ����
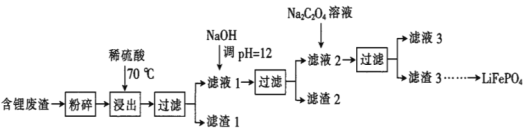
��֪����Һ1����Һ2�в������ӵ�Ũ�ȣ�g��L-1����
Li+ | Ni2+ | Mg2+ | |
��Һ1 | 22.72 | 20.68 | 60.18 |
��Һ2 | 21.94 | 7.7��10-3 | 0.78��10-3 |
I.�Ʊ�Li2C2O4
(1)����2����Ҫ�ɷ���__���ѧʽ����
(2)Na2C2O4��Һ�и����ӵ�Ũ���ɴ�С˳��Ϊ__��
(3)д������Na2C2O4��Һʱ������Ӧ�����ӷ���ʽ��__��
��.�Ʊ�LiFePO4
(4)����ؼ�Li2C2O4��FePO4���ڸ����·�Ӧ����LiFePO4��һ���������壬�÷�Ӧ�Ļ�ѧ����ʽ��___��
(5)LiFePO4��Ҫ�ڸ����³��ͺ������Ϊ�缫�����³���ʱҪ��������ʯī����ʯī��������__����дһ�㣩��
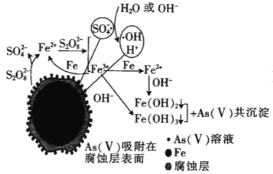
(6)�ҹ���ѧ���о��������������ƣ�Na2S2O8��ȥ����ˮ�е�As(��)�������ģ����ͼ�������������������Ʒ�Ӧ�����ӷ���ʽ��__���ڸ�ģ���еõ������鹲�����ᆳ���գ���Ԫ�ػ��ϼ۱仯����õ�һ�ִ��Ի������ѧʽΪFe7As2O14���������ж��������������ĸ�����Ϊ__��