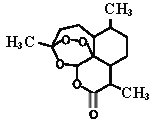
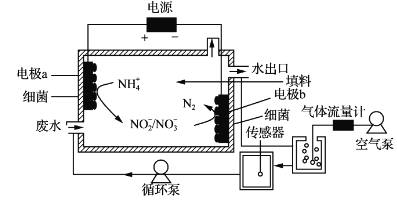
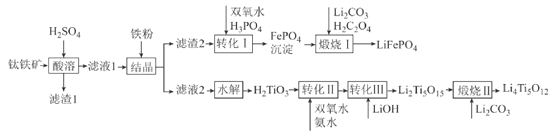
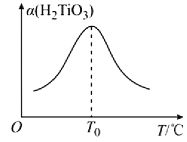
题目内容
【题目】(1)FeCl3的水溶液呈___________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________________________________,
(2)实验室在配制好的FeCl3溶液中加少许稀盐酸的目的是:__________________ 。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是__________________ 。
【答案】酸 Fe3++3H2O ![]() Fe(OH)3+3H+ 抑制FeCl3的水解 Fe2O3
Fe(OH)3+3H+ 抑制FeCl3的水解 Fe2O3
【解析】
铁离子水解生成氢氧化铁和氢离子;盐酸可抑制铁离子水解,加热,促进氯化铁水解,生成的氯化氢容易挥发,据此分析解答。
(1)FeCl3为强酸弱碱盐,铁离子水解,溶液呈酸性,原因是:Fe3++3H2O![]() Fe(OH)3+3H+,故答案为:酸;Fe3++3H2O
Fe(OH)3+3H+,故答案为:酸;Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(2)实验室在配制好的FeCl3溶液中加少许稀盐酸,以抑制铁离子水解,故答案为:抑制FeCl3的水解;
(3)加热,促进氯化铁水解,生成的氯化氢容易挥发,因此将FeCl3溶液蒸干,得到氢氧化铁固体,灼烧,最后得到的主要固体产物是Fe2O3,故答案为:Fe2O3。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是________,此时锥形瓶内溶液的pH为_____________。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留四位有效数字)
③排去碱式滴定管中气泡的方法应采用操作__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____
A、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
B、锥形瓶水洗后未干燥
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、配制NaOH标准溶液时,移液后未洗涤烧杯和玻璃棒
E、碱式滴定管尖嘴部分有气泡,滴定后消失