题目内容
18.(1)将下列物质进行分类:①正丁烷与异丁烷、②红磷与白磷、③乙醇(CH3CH2OH)与二甲醚(CH3OCH3)④金刚石和石墨、⑤冰与水、⑥16O与18O、⑦干冰与二氧化碳,用数字序号回答下列问题:
A.互为同素异形体的是②④
B.互为同分异构体的是①③
C.属于同位素的是⑥
D.属于同一种化合物的是⑤⑦
(2)某元素最高正化合价为+6,其最低负价为-2.某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为R2O5.
(3)试判断:①SiO2②CO2③KCl晶体的熔点由高到低排列的顺序:①>③>②(填相应物质的编号).
分析 (1)相同元素组成,不同形态的单质互为同素异形体;
具有相同分子式而结构不同的化合物互为同分异构体;
有相同质子数,不同中子数的原子互为同位素;
分子式相同、结构相同的化合物为同种物质;
(2)主族元素最高正价与最低负价绝对值之和为8;依据化合物中各元素化合价代数和为0写化学式;
(3)一般来说,晶体熔沸点大小顺序是原子晶体>离子晶体>分子晶体.
解答 解:(1)A.②红磷与白磷都是由磷元素形成的不同单质,故互为同素异形体;
④金刚石和石墨都是由碳元素形成的不同单质,故互为同素异形体;
B.①正丁烷与异丁烷,二者分子式相同,结构不同,属于同分异构体;
③乙醇(CH3CH2OH)与二甲醚(CH3OCH3),二者分子式相同,结构不同,属于同分异构体;
C.⑥16O与18O二者质子数都是8,前者中子数为8,后者中子数为10,属于同位素;
D.⑤冰与水是水的不同状态,分子式相同、结构相同,属于同种物质;
⑦干冰与二氧化碳是二氧化碳的不同状态,分子式相同、结构相同,属于同种物质;
故答案为:②④;①③;⑥;⑤⑦;
(2)主族元素最高正价与最低负价绝对值之和为8,某元素最高正化合价为+6,8-6=2,所以最低负价为-2价;
某元素R与氢形成的气态氢化物的化学式为RH3,则最低负价为-3价,最高正极为8-3=5,最高价氧化物化学式为:R2O5;
故答案为:-2;R2O5;
(3)①SiO2属于原子晶体;②CO2属于分子晶体,③KCl晶体属于离子晶体,一般来说,晶体熔沸点大小顺序是原子晶体>离子晶体>分子晶体,所以熔点由高到低排列的顺序:①>③>②;
故答案为:①>③>②.
点评 本题考查了同位素、同素异形体、同分异构体、同种物质的判断、元素化合价规律、晶体熔沸点判断,明确相关概念、不同晶体类型熔沸点大小规律是解题关键,题目难度不大.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案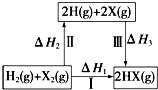
| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | 生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | F、Cl、Br的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 | |
| D. | F2、Cl2分别发生反应I,同一温度下的平衡常数分别为K1、K2,则K1>K2 |
| A. | 原子序数是99 | B. | 质量数是43 | C. | 中子数是99 | D. | 电子数是43 |
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ②③④⑤ |
| A. | Na与水反应时.增加水的用量 | |
| B. | Al与稀硫酸反应制取H2时.改用浓硫酸 | |
| C. | Na2SO4与BaCl2两种溶液反应时.增大压强 | |
| D. | 大理石和盐酸反应制取C02时.将块状大理石改为粉末状 |
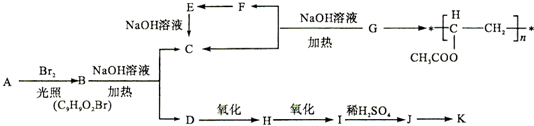
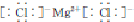 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.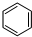 (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$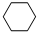 (g)
(g) 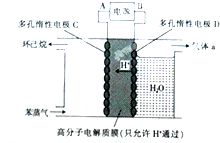
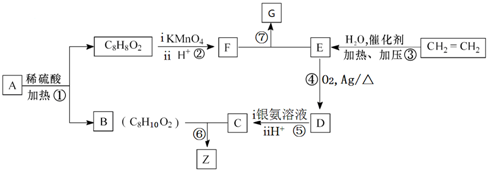
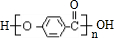
 2CH3CHO+2H2O,在①~⑦的反应中,属于取代反应的有①⑥⑦.
2CH3CHO+2H2O,在①~⑦的反应中,属于取代反应的有①⑥⑦.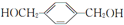 ,其所含官能团名称为羟基.
,其所含官能团名称为羟基. .
.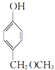 ,
,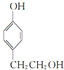 ,
,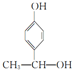 ,
,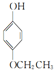 ,.
,.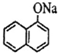 ,试剂b中官能团的名称是氯原子、碳碳双键.③的反应类型是氧化反应.
,试剂b中官能团的名称是氯原子、碳碳双键.③的反应类型是氧化反应. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.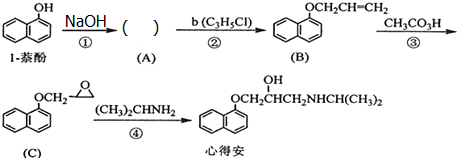
 .
.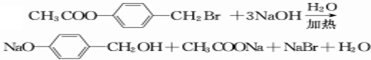 .
.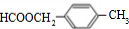 .
.