题目内容
8.下列鉴别方法可行的是( )| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
分析 A.Al3+、Mg2+均与氨水反应生成白色沉淀;
B.SO42-与氯化钡反应生成白色沉淀,CO32-与氯化钡反应生成的白色沉淀可溶于盐酸;
C.乙烯与溴水反应,而甲烷不能;
D.CH3CH2OH和CH3CHO均能被高锰酸钾氧化.
解答 解:A.Al3+、Mg2+均与氨水反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.SO42-与氯化钡反应生成白色沉淀,CO32-与氯化钡反应生成的白色沉淀可溶于盐酸,均与氯离子不能反应,现象不同,可鉴别,故B正确;
C.乙烯与溴水反应使其褪色,而甲烷不能,现象不同,可鉴别,故C正确;
D.CH3CH2OH和CH3CHO均能被高锰酸钾氧化,现象相同,不能鉴别,故D错误;
故选BC.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)( )
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
19.关于反应2SO2+O2$?_{△}^{催化剂}$2SO3的说法正确的是( )
| A. | 适宜条件下,SO2和O2可以完全转化为SO3 | |
| B. | 反应达到平衡后正逆反应的速率皆为零 | |
| C. | 若用18O2进行反应,达到平衡时二氧化硫中也会有18O | |
| D. | 工业合成SO3时,既要考虑反应速率也要考虑反应限度 |
16.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |
18.推理是一种重要的思维方法.下列推理合理的是( )
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
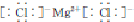 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能. (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$ (g)
(g) 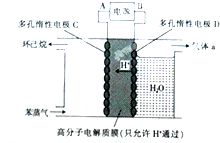
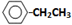 .
.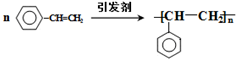 .
.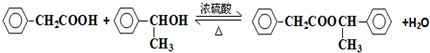 .
.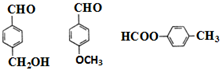 (其中两种).
(其中两种). ,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.
,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.

 ,它的分子中含有4种不同化学环境的氢原子.
,它的分子中含有4种不同化学环境的氢原子. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.