题目内容
11.下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
分析 离子晶体熔化克服离子键,原子晶体熔化克服共价键,金属晶体熔化克服金属键,分子晶体熔化或升华克服分子间作用力,以此来解答.
解答 解:A、Na2O熔化克服离子键、SiO2熔化克服共价键,类型不同,故A错误;
B、冰是分子晶体、金刚石是原子晶体,晶体类型不同,克服的作用力不同,故B错误;
C、氯化钠熔化克服离子键,蔗糖熔化克服分子间作用力,类型不同,故C错误;
D、碘和干冰均属于分子晶体,升华时均克服分子间作用力,类型相同,故D正确;
故选:D.
点评 本题考查晶体类型及化学键,明确不同类型的晶体在熔化时克服不同的作用力是解答本题的关键,题目难度不大,注意把握晶体类型.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
1.分子式为C5H120且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
2.将KO2放人密闭的真空容器中,一定条件下,发生反应:4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
19.关于反应2SO2+O2$?_{△}^{催化剂}$2SO3的说法正确的是( )
| A. | 适宜条件下,SO2和O2可以完全转化为SO3 | |
| B. | 反应达到平衡后正逆反应的速率皆为零 | |
| C. | 若用18O2进行反应,达到平衡时二氧化硫中也会有18O | |
| D. | 工业合成SO3时,既要考虑反应速率也要考虑反应限度 |
6.下列分离方法中,正确的是( )
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ②③④⑤ |
16.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |
1.下列物质的性质与应用对应关系不正确的是( )
| A. | 亚硫酸钠有还原性,可用作脱氧剂 | B. | FeCl3有氧化性,可用于制印刷电路 | ||
| C. | 铝有还原性,可冶炼某些金属 | D. | 浓硫酸有吸水性,可用于干燥氨气 |
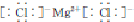 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能. (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$ (g)
(g) 
 ,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.
,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.