题目内容
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:

(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
【答案】3 酯键、羟基 ![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O
+Cu2O↓+3H2O  CH3N=C=O
CH3N=C=O 
【解析】
(1)根据B物质的结构简式可知,分子中含有3个手性碳原子,即![]() ,根据D的结构简式可知,化合物D中含氧官能团的名称为酯基、羟基,故答案为3; 酯基、羟基;
,根据D的结构简式可知,化合物D中含氧官能团的名称为酯基、羟基,故答案为3; 酯基、羟基;
(2)C中含有醛基,能和新制的氢氧化铜悬浊液反应,则C与新制氢氧化铜反应的化学方程式为![]() ,故答案为
,故答案为![]() ;
;
(3)能发生银镜反应和水解反应,这说明分子中含有酯基和醛基。能与FeCl3溶液发生显色反应,说明分子中含有酚羟基。又因为核磁共振氢谱有4个峰,所以应该是甲酸形成的酯,则可能的结构简式有 ,故答案为
,故答案为 ;
;
(4)根据EF的结构简式并根据原子守恒可知,该反应应该是加成反应,所以X的结构简式应该是CH3N=C=O,故答案为CH3N=C=O;
(5)![]() 可发生催化氧化生成
可发生催化氧化生成![]() ,然后发生消去反应生成
,然后发生消去反应生成![]() ,然后发生取代反应生成
,然后发生取代反应生成![]() ,进而与
,进而与![]() 作用可生成目标物,反应流程为
作用可生成目标物,反应流程为 ,故答案为
,故答案为 。
。
【点晴】
本题考查考查较为综合,涉及有机物手性碳原子、官能团、结构简式、同分异构体、方程式以及有机合成路线的设计等,是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练。该类试题能较全面地考查学生的有机化学基础知识和逻辑思维能力、创造思维能力,提高学生的应试能力和答题效率,也有利于培养学生的自学能力和知识的迁移能力。该题的关键是记住常见官能团的结构、性质以及官能团之间的相互转化,然后结合题意灵活运用即可。

【题目】滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为____,为何此种情况能测出NaOH的含量?____。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?____,请说明理由:___。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后用5.0×10-4mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-=2I-+S4O62-)。取用Na2S2O3的标准溶液应该用_____式滴定管。有关实验数值如表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
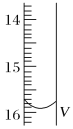
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | V=_____ |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为_____,下列操作中,会导致所测得的碘元素的百分含量偏大的是____。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水