题目内容
【题目】滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为____,为何此种情况能测出NaOH的含量?____。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?____,请说明理由:___。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后用5.0×10-4mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-=2I-+S4O62-)。取用Na2S2O3的标准溶液应该用_____式滴定管。有关实验数值如表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
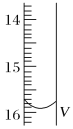
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | V=_____ |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为_____,下列操作中,会导致所测得的碘元素的百分含量偏大的是____。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
【答案】由红色变成无色 滴定终点时溶液呈弱碱性,BaCO3不参与反应 不能 因为活塞处无刻度,无法准确地读出所用标准盐酸的体积 碱 15.90 0.03175% b
【解析】
(1)①根据酚酞的变色范围是8~10分析;
②根据滴定管的下端无刻度判断;
(2)碱性溶液用碱式滴定管盛放;依据滴定管的科学读数方法读取数据;先求出三次的体积,根据数据的有效性,舍去第1组数据,然后求出2、3组平均消耗V(Na2S2O3),由浓度求出其物质的量,再根据方程式中的关系求出25mL待测溶液中KIO3的物质的量,然后求出KIO3的总物质的量和质量,其质量分数=![]() ×100%;根据错误操作对消耗的标准溶液体积的影响分析误差。
×100%;根据错误操作对消耗的标准溶液体积的影响分析误差。
(1)①当达到终点时,溶液显弱碱性,酚酞由红色变为无色;酚酞的变色范围是810,此时BaCO3不溶解,标准液的体积不变,不影响NaOH含量的测定;
故答案为:由红色变成无色;滴定终点时溶液呈弱碱性,BaCO3不参与反应;
②根据滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积,则不能测出NaOH含量;
故答案为:不能,因为活塞处无刻度,无法准确地读出所用标准盐酸的体积;
(2)碱性溶液用碱式滴定管盛放,Na2S2O3在溶液中水解显碱性,所以用碱式滴定管盛放;由图可知,滴定管读数为15.90;三次消耗的Na2S2O3的体积分别为15.90mL,14.99mL,15.01mL,第一次数据误差过大,应该舍去;另外两次的平均值为![]() =15.00mL,则n(Na2S2O3)=cV=5.0×104molL1×0.015L=7.5×106 mol,已知发生反应为:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32=2I+S4O62,则
=15.00mL,则n(Na2S2O3)=cV=5.0×104molL1×0.015L=7.5×106 mol,已知发生反应为:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32=2I+S4O62,则
KIO33I26S2O32
1 6
n 7.5×106mol
所以n(KIO3)=![]() mol=1.25×106 mol,则KIO3的总物质的量为:1.25×106mol×
mol=1.25×106 mol,则KIO3的总物质的量为:1.25×106mol×![]() =1.25×105 mol,则n(I)=n(KIO3)=1.25×105 mol,m(I)=nM=1.25×105 mol×127g/mol=1.5875×103 g,所以碘盐中碘元素的百分含量为
=1.25×105 mol,则n(I)=n(KIO3)=1.25×105 mol,m(I)=nM=1.25×105 mol×127g/mol=1.5875×103 g,所以碘盐中碘元素的百分含量为![]() ×100%=0.03175%;
×100%=0.03175%;
a.滴定终点时,俯视刻度,则读数偏小,所以标准溶液的体积偏小,求出KIO3的物质的量的偏小,所以所测得的碘元素的百分含量偏小,a项错误;
b.没有用Na2S2O3标准溶液润洗相应的滴定管,则Na2S2O3的浓度减小,滴定时消耗的Na2S2O3的体积偏大,求出KIO3的物质的量的偏大,所以所测得的碘元素的百分含量偏大,b项正确;
c.锥形瓶中有少量的蒸馏水对测定结果无影响,c项错误;故选b,
故答案为:碱;15.90;0.03175%;b。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】实验室需配制80mL0.1mol/L的碳酸钠溶液,填空并回答下列问题:
(1)配制80mL1.0mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
___ | ___ |
(2)配制时,其正确的操作顺序为___(用字母表示,每个字母只能用一次)。
A.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
B.将容量瓶盖紧,上下颠倒,摇匀
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
F.改为胶头滴管加水,使溶液凹液面恰好与刻度线相切
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若定容时仰视刻度线,结果会___;
若容量瓶中有少量蒸馏水,结果会___。
【题目】在1.013×105 Pa下,测得的某些烷烃的沸点见下表。据表分析,下列说法正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体
B. 在1.013×105 Pa、20 ℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低
D. C5H12随支链增加,沸点降低
【题目】如表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是____(填元素编号)。d、e、f三种元素的原子结构上的相同点是___。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是____;六种元素中,最高价氧化物对应水化物的酸性最强的是____(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_____(选填“强”、“弱’’)。
(4)若b为非金属元素,则以下推断正确的是____(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素