题目内容
【题目】(1)现有下列物质:①K2SO4晶体;②液态SO3;③冰醋酸(即纯醋酸);④汞;⑤小苏打;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠。其中:能导电的是______________(填序号,下同);属于非电解质的是_________属于强电解质的是_____________;弱电解质的电离方程式:_________
(2)已知0.1 mol/L的NaHSO4溶液中H+的浓度为0.1mol/L,若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为________,此时溶液呈____性。
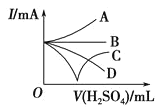
(3)若向Ba(OH)2溶液中缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_________(填序号)曲线表示。
【答案】④⑧ ②⑥⑦ ①⑤⑧ CH3COOH![]() CH3COO-+H+ H++SO42-+OH-+Ba2+=BaSO4↓+H2O 碱 C
CH3COO-+H+ H++SO42-+OH-+Ba2+=BaSO4↓+H2O 碱 C
【解析】
(1)根据含有自由移动的带电微粒(如离子、电子)的物质能导电;电解质是在熔融态或在水溶液里能导电的化合物,非电解质是在水溶液里和熔融状态下都不能导电的化合物,强电解质是在水溶液中完全电离的电解质;弱电解质是在水溶液中只有部分电离产生自由移动的离子,存在电离平衡;
(2)根据二者反应的物质的量比关系,书写反应方程式和离子方程式,根据溶液中c(H+)、c(OH-)的相对大小,判断溶液的酸碱性;
(3)开始时溶液中含有大量的Ba2+、OH-,溶液导电能力很强,稀硫酸不断加入,直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强;
(1)④汞中含有自由移动的电子,能够导电;⑧熔融的氯化钠中含有自由移动的Na+、Cl-,能够导电,故能够导电的选项是④⑧;
②液态SO3;⑥蔗糖;⑦乙醇都是由分子构成的化合物,在水溶液或熔融状态,都不能因自身电离产生自由移动的微粒而导电,因此都是非电解质,故属于非电解质的选项是②⑥⑦;
①K2SO4晶体、⑤小苏打、⑧熔融的氯化钠都属于可溶性的盐,在水中能够完全电离,属于强电解质,故属于强电解质的选项是①⑤⑧;
③冰醋酸(即纯醋酸)由分子构成,溶于水后,在水分子作用下,能够部分电离,产生自由移动的CH3COO-、H+,存在电离平衡,属于弱电解质,电离方程式为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
(2)已知0.1 mol/L的NaHSO4溶液中H+的浓度为0.1mol/L,NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-,若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,发生反应:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,离子方程式为H++SO42-+OH-+Ba2+=BaSO4↓+H2O,此时溶液中c(OH-)>c(H+),所以溶液呈碱性;
(3)向Ba(OH)2溶液中缓缓加入稀H2SO4直至过量,恰好反应时,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,反应开始时,溶液中含有Ba(OH)2电离产生的Ba2+、OH-,溶液导电能力很强,随着硫酸的加入,溶液中Ba2+、OH-浓度降低,溶液的导电性减弱,当二者恰好反应时,溶液中几乎无自由移动的离子,导电性为0,当硫酸过量时,溶液中又有硫酸电离产生的H+、SO42-,且硫酸越多,溶液中过量硫酸电离产生H+、SO42-离子浓度增大,导电性又逐渐增强,故图中只有曲线C符合导电性变化趋势。