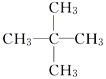
题目内容
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
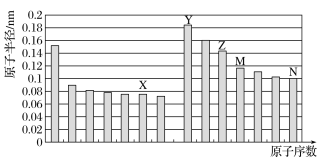
A.M在周期表中的位置为:第三周期,IV族
B.Y和N形成的化合物为离子化合物
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
【答案】B
【解析】
图中元素分别为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为Na元素,Z为Al元素,M为Si元素,N为Cl元素,结合对应物质的性质解答该题。
A.M为Si元素,硅在元素周期表中的位置是第三周期、IVA族,故A错误;
B.Y是Na,N是Cl元素,形成的化合物NaCl为离子化合物,故B正确;
C.水分子间能形成氢键,所以水的沸点大于HCl,故C错误;
D.Na元素和O元素可以形成Na2O2,阴、阳离子物质的量之比为1:2,故D错误。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案【题目】在1.013×105 Pa下,测得的某些烷烃的沸点见下表。据表分析,下列说法正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体
B. 在1.013×105 Pa、20 ℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低
D. C5H12随支链增加,沸点降低
【题目】如表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是____(填元素编号)。d、e、f三种元素的原子结构上的相同点是___。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是____;六种元素中,最高价氧化物对应水化物的酸性最强的是____(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_____(选填“强”、“弱’’)。
(4)若b为非金属元素,则以下推断正确的是____(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素