题目内容
9.下列说法正确的是( )| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
分析 A.聚乙烯不能发生加成反应;
B.二氧化氯具有强氧化性,三氯化铁能水解生成氢氧化铁胶体;
C.Ksp只与难溶电解质的性质和温度有关;
D.Na2O2是由钠离子和过氧根离子构成的,1molO22-中含有1mol共用电子对;
解答 解:A.乙烯能和溴水发生加成反应而使溴水褪色,而聚乙烯中不含不饱和键,不能使溴水褪色,故A错误;
B.二氧化氯具有强氧化性,能杀菌消毒,三氯化铁能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附水中的悬浮颗粒,二者的作用原理不相同,故B错误;
C.Ksp只与难溶电解质的性质和温度有关,与溶液中离子浓度无关,故C错误;
D.Na2O2是由钠离子和过氧根离子构成的,1molO22-中含有1mol共用电子对,则7.8g过氧化钠即0.1mol,含有共用电子对为0.1NA,故D正确;
故选D.
点评 本题考查了有机物的性质、净水原理的分析、溶度积常数、过氧化钠的构成,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
12.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
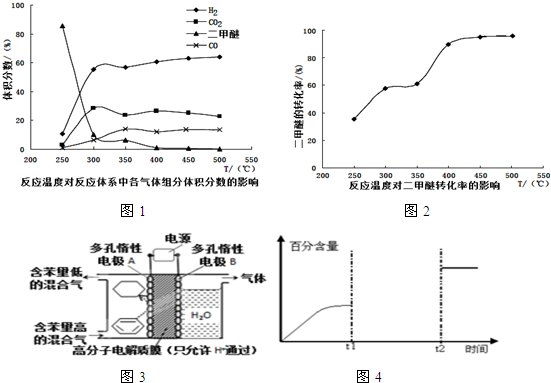
4. 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
14.某无色溶液中含Na+、I-、NO3-、Cl-,加入下列哪种溶液不会使其变色( )
| A. | 淀粉溶液 | B. | 硫酸氢钠溶液 | C. | H2O2溶液 | D. | 氯水 |
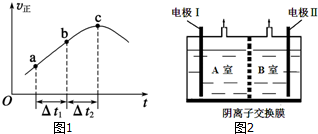
1.某同学设计原电池装置如图所示.下列说法正确的是( )


| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
19.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
 .
. 氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.