题目内容
13.A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等.请用化学用语回答下列问题:
(1)E元素在周期表中的位置为第三周期第ⅢA族,请写出E最高价氧化物对应水化物的电离方程式:H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为O2->Na+>Al3+;由A、B、C三种元素组成的18电子微粒的分子式为CH4O.
(3)用电子式表示BC2的形成过程:
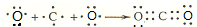 .
.(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1mol该分子在一定条件下可以还原4mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水.请写出化学方程式:N2H4+4CuO$\frac{\underline{\;一定条件\;}}{\;}$N2+2Cu2O+2H2O.
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:Cu+2H++H2O2=Cu2++2H2O.
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,若将1mol DA和1mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是56L.
分析 A、C能形成两种液态化合物A2C和A2C2,该液态化合物分别为H2O和H2O2,则A为H元素,C为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,处于ⅢA族元素,故E为Al元素;A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为碳元素,结合元素对应的单质、化合物的性质可解答该题.
解答 解:A、C能形成两种液态化合物A2C和A2C2,该液态化合物分别为H2O和H2O2,则A为H元素,C为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,处于ⅢA族元素,故E为Al元素;A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为碳元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,氢氧化铝的电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:第三周期第ⅢA族;H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,由H、C、O三种元素组成的18电子微粒的分子式为CH4O,
故答案为:O2-;Na+;Al3+;CH4O;
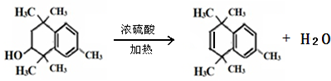
(3)用电子式表示CO2的形成过程: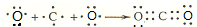 ,
,
故答案为: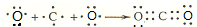 ;
;
(4)原子序数比C小1的元素F为氮元素,也能与氢元素形成18电子的分子,该分子为N2H4,1mol该分子在一定条件下可以还原4mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水,该气体单质为氮气,设Cu元素在还原产物中的化合价为x,根据电子转移守恒,则1mol×2×[0-(-2)]=4mol×(2-x),解得x=1,故红色固体为Cu2O,反应化学方程式:N2H4+4CuO$\frac{\underline{\;一定条件\;}}{\;}$N2+2Cu2O+2H2O,
故答案为:N2H4+4CuO$\frac{\underline{\;一定条件\;}}{\;}$N2+2Cu2O+2H2O;
(5)Cu、稀硫酸、H2O2反应生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(6)NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56.
点评 本题考查元素化合物的推断、常用化学用语、化学计算等,A、C形成的化合物为推断突破口,(4)为易错点,学生容易认为红色固体为Cu,忽略根据电子转移守恒判断,需要学生具备扎实的基础和综合运用知识解决问题的能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
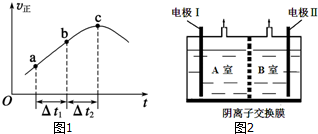
小学生10分钟应用题系列答案 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )| A. | 反应开始时,电子从甲池电极移向乙池电极 | |
| B. | 平衡时电流表指针为零,两池溶液颜色相同 | |
| C. | 平衡时Fe3+氧化性比I2强 | |
| D. | 平衡时向甲池中溶入FeCl2固体后,乙池的石墨电极为正极 |
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
| A. | 原子半径:乙>丙>丁 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最髙价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均为共价化合物 |
| A. | 盐酸 | B. | 氢氧化钠 | C. | 氯化钡 | D. | 硝酸银 |
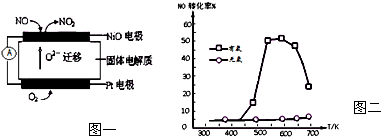
(1)连续自动监测氮氧化物(NOx)的仪器--动态库仑仪已获得实际应用.它的工作原理如下图一所示.NiO电极上NO发生的电极反应式为NO+O2--2e-=NO2.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$.(用△H1和△H2表示)
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
A.增加催化剂的表面积B.改用高效催化剂 C.降低温度
D.增大压强E.分离出H2O(g) F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数.(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图.
(4)SNCR是一种新型的烟气脱氮环保技术.在有氧条件下,其脱氮原理是:NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1.NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示.图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条):脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.
 氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
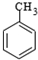 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$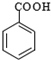
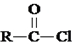
 .
. .
.
 .
.