题目内容
【题目】硼酸和硫酸镁是重要的化工原料。以硼铁混精矿[主要成分为MgBO2(OH)、UO2和Fe3O4,还有少量的Fe2O3、FeO、SiO2]为原料制备硼酸和硫酸镁的工艺流程如下:
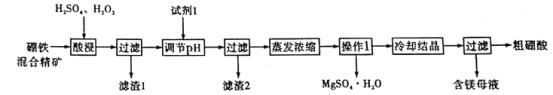
已知:①UO22+在pH为4-5的溶液中生成UO2(OH)2沉淀;②Fe2+和Fe3+沉淀完全的pH分别为9.7、3.7。
(1)酸浸过程中MgBO2(OH)与硫酸反应的离子方程式为_____。
(2)酸浸过程中加入H2O2的目的是______(写出两条),滤渣1的主要成分是___(填化学式)。
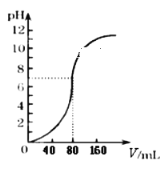
(3)试剂1最好选择_____(填化学式)。若调节溶液pH前,溶液中c(Mg2+)=0.2 mol/L,当溶液pH调至5时,UO2+沉淀完全,此时是否有Mg(OH)2沉淀生成____。{通过计算说明,Ksp[Mg(OH)2]=5.6×10-12}
(4)操作1的名称是_____。
(5)MgSO4·H2O加热脱水可以得无水MgSO4,那么MgCl2·6H2O晶体直接加热___(填“能”或“不能”)得到无水MgCl2,理由是_______。
(6)已知:H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H3BO3的Ka=5.8×10-10。向碳酸钠溶液里逐滴加入硼酸溶液____(填“有”或“无”)气泡产生,理由是____。
【答案】MgBO2(OH)+2H+=Mg2++H3BO3 将Fe2+氧化为Fe3+,将UO2氧化成UO22+便于后续过程除去 SiO2 MgO或者Mg(OH)2或者MgCO3 c(Mg2+)×c2(OH-)=0.2×(10-9)2=2×10-19<Ksp[Mg (OH) 2]=5.6×10-12,因此不会产生Mg (OH) 2沉淀 趁热过滤 不能 加热时促进了MgCl2的水解,最终得到氢氧化镁、氧化镁或碱式碳酸镁 无 硼酸的酸性比碳酸弱
【解析】
用硫酸酸化的H2O2溶解硼铁混精矿,其中SiO2不溶于水和酸,经过滤可除去,所得滤液中主要含有UO22+、Fe3+、Mg2+及H3BO3,用MgO或者Mg(OH)2或者MgCO3调节溶液pH,使溶液中Fe3+完全转化为Fe(OH)3沉淀,并经过滤得滤渣2,将滤液蒸发、浓缩,趁热过滤,获得MgSO4·H2O晶体析出,将滤液冷却结晶,过滤可得粗硼酸,据此分析解题。
(1)酸浸过程中MgBO2(OH)与硫酸反应,生成硼酸和硫酸镁,发生反应的离子方程式为MgBO2(OH)+2H+=Mg2++H3BO3;
(2)酸浸过程中加入H2O2,利用H2O2的氧化性,将Fe2+氧化为Fe3+,同时将UO2氧化成UO22+便于后续过程除去;SiO2不溶于水和酸,则滤渣1的主要成分是SiO2;
(3)添加试剂1是调节溶液pH,则试剂1能与酸反应,且不引入新的杂质,故最好选择MgO或者Mg(OH)2或者MgCO3;c(Mg2+)=0.2 mol/L,当溶液pH调至5时,c(OH-)=1×10-9mol/L,则c(Mg2+)×c2(OH-)=0.2×(10-9)2=2×10-19<Ksp[Mg (OH) 2]=5.6×10-12,因此不会产生Mg (OH) 2沉淀。
(4)结合以上分析可知,将滤液蒸发、浓缩,趁热过滤,获得MgSO4·H2O晶体析出,所以操作1的名称是趁热过滤;
(5)MgCl2能水解生成Mg (OH) 2和HCl,MgCl2·6H2O晶体直接加热时,促进Mg2+水解,且HCl挥发,则最终得到氢氧化镁、氧化镁或碱式碳酸镁,而不能得到无水MgCl2;
(6)已知:H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H3BO3的Ka=5.8×10-10,则硼酸的酸性介于H2CO3和HCO3-之间,根据强酸制弱酸的原理,向碳酸钠溶液里逐滴加入硼酸溶液只能生成NaHCO3和NaBO3,无碳酸生成,即无气泡产生。

【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
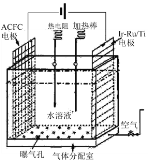
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
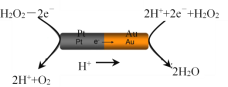
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
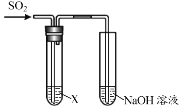
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。