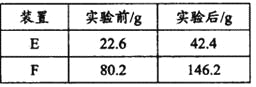
��Ŀ����
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�֡������е������Լ����ա����ȶ����������֪��
�����ԣ�IO3����Fe3+��I2����ԭ�ԣ�S2O32����I����3I2+6OH���TIO3��+5I��+3H2O��KI+I2![]() KI3
KI3
ijѧϰС��Լӵ��ν�������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ��
��1������һ����Һ�еμ�KSCN��Һ�Ժ�ɫ���ú�ɫ������ ���û�ѧʽ��ʾ����
���ڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ �� ��
��2����KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� ��
����I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ� ����ǡ�������˵������ ��
��3������6mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ���������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺
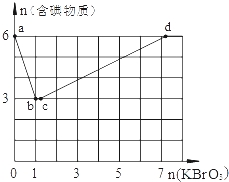
����֪b��ʱ��KI��Ӧ��ȫ��ת�Ƶĵ�����Ϊ ��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ ��
��d��ʱ��n��KBrO3��Ϊ ��
��������1����Fe��SCN��3 ��IO3-��5I����6H����3I2��3H2O��2Fe3����2I����2Fe2����I2
��2����O2��4KI��2H2O��2I2��4KOH
�ڷ�KI3���ȣ���ʪ��������KI��I2��KI�ױ���������ΪI2��I2����������
��3����6NA����3.612��1024����1��5 ��7.2mol
��������
�����������1���ټ�KSCN��Һ���Ժ�ɫ�������ķ�ӦΪ��Fe3����3SCN����Fe��SCN��3��
�������Ϸ�����֪���ӵ����к���Fe3����IO3-����Һ�м�������KI������������ӷ�ӦΪ��IO3-��5I����6H����3I2��3H2O,2Fe3����2I����2Fe2����I2��
��2����KI���л�ԭ�ԣ��ڳ�ʪ�Ļ�������O2����������ԭ��Ӧ��O2��4KI��2H2O��2I2��4KOH��
����������Ϣ��֪��KI3��H2O�����ȣ���ʪ���������·�����ӦKI3![]() KI��I2����KI�ױ���������ΪI2����I2�������������Ӷ���������ʧ����KI3��H2O���ʺ���ʳ�μӵ����
KI��I2����KI�ױ���������ΪI2����I2�������������Ӷ���������ʧ����KI3��H2O���ʺ���ʳ�μӵ����
��3������֪b��ʱ��KI��Ӧ��ȫ����Ӧ�����ĺ��е�Ԫ�ص����ʵ�����3mol��˵����Ӧ������I2��6molKI������Ӧ����3mol��I2��Ӧ����ʽ�ǣ�6I-+BrO3-+6H+��3I2+Br-+3H2O��ת�Ƶĵ�����Ϊ6NA��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧ����Br-��BrO3-֮�䷢��������ԭ��Ӧ����Ӧ�����ӷ���ʽ�ǣ�5Br-+BrO3-+6H+��3Br2+3H2O,��ʱ�������뻹ԭ�������ʵ���֮��Ϊ1:5��
�۷����ķ�Ӧ�����ǣ�6I-+6H++BrO3-��3I2+Br-+3H2O��BrO3-+5Br-+6H+��3Br2+3H2O��BrO3-+I2��2IO3-+Br2���ܷ�Ӧ����ʽ�ǣ�5I-+6H++6BrO3-��5IO3-+3Br2+3H2O�����ݷ���ʽ��֪6molKI��ȫ��Ӧ����Ҫ����KBrO3�����ʵ�����6mol��6/5��7.2mol������d��ʱ��n��KBrO3����7.2mol��