题目内容
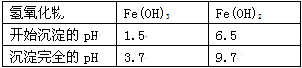
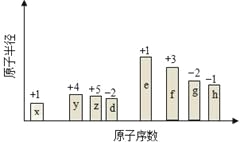
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:
(1)f在元素周期表的位置是____________________________。
(2)比较d、e常见离子的半径大小______>______(用化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性强弱___________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式______________________。
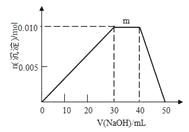
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化如图所示。
① 写出m段反应的离子方程式_______________________________。
② 若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________mol。
【答案】(1)第三周期第IIIA族(2分)(2)O2–>Na+(2分),HClO4>H2SO4(2分)
(3)![]() 或
或![]() 或
或![]() (2分)
(2分)
(4)①NH4++OH–=NH3·H2O(2分) ②0.02(2分)
【解析】试题分析:根据元素的原子序数、原子半径及元素的化合价可确定x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。
(1)f是Al元素,在元素周期表中位于第三周期ⅢA族;
(2)根据以上分析可知d是O元素,e是Na元素,二者形成的简单离子O2-、Na+核外电子排布都是2、8,电子层结构相等,对于电子层结构相同的离子,核电荷数越大,离子半径越小,所以d、e简单离子的半径大小r(O2-)>r(Na+);g是S元素,h是Cl元素,非金属性越强最高价含氧酸的酸性越强,则酸性强弱顺序为HClO4>H2SO4;
(3)在上述元素组成一种四原子共价化合物如NH3,其电子式是![]() 。
。
(4)上述元素可组成盐R:zx4f(gd4)2是复盐NH4Al(SO4)2。
①在NaOH溶液30mL~40mL时沉淀质量不变,发生反应为NH4++OH-=NH3·H2O;
②在10mL1mol·L-1R溶液中含Al3+的物质的量是1mol/L×0.01L=0.01mol;含有SO42-的物质的量是n(SO42-)=0.02mol,若在R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,n[Ba(OH)2)]=1.2mol/L×0.02L=0.024mol,n(Ba2+)=0.024mol,n(OH-)=2×0.024mol=0.048mol,会发生反应:Ba2++SO42-=BaSO4↓,二者发生反应的物质的量的比是1:1,根据二者的物质的量可知Ba2+过量,反应产生的BaSO4以SO42-为标准计算,n(BaSO4)=0.02mol;Al3+会发生反应:Al3++3OH-=Al(OH)3↓,由于n(Al3+)=0.01mol,n(OH-)=0.048mol,根据反应关系可知OH-过量,形成沉淀以Al3+为标准,形成0.01mol Al(OH)3,反应消耗0.03mol OH-,过量的OH-会发生反应:Al(OH)3+OH-=AlO2-+2H2O,二者反应的物质的量的比是1:1,由于Al(OH)3物质的量是0.01mol,溶液中含有OH-0.018mol,OH-过量,最后Al(OH)3完全被溶解变为AlO2-,因此溶液中产生沉淀是0.02mol硫酸钡。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
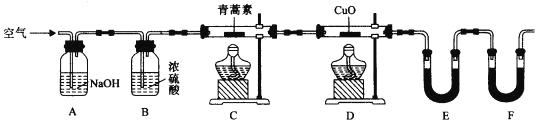
小学期末标准试卷系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

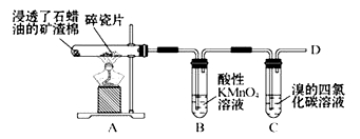
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
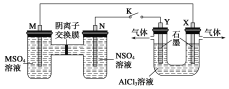
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |