题目内容
8.如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.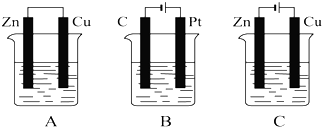
(1)A、B、C三个装置中属于原电池的是A属于电解池的是BC.
(2)A池中Zn是负极,Cu极发生还原(填“氧化”或“还原”)反应,电极反应为Cu2++2e-=Cu.反应过程溶液中c(Cu2+)变小(填“变大”“变小”或“不变”).
(3)B池中C棒是阴极极,一段时间后的现象为碳棒表面有红色物质生成,电极反应为Cu2++2e-=Cu.B 池中的总反应为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑.
(4)C池在化学反应中发生的能量转化形式是电能转化为化学能.
分析 (1)把化学能转变为电能的装置是原电池,把电能转化为化学能的装置是电解池,所以电解池有外接电源;
(2)铜、锌原电池中,锌为负极,被氧化,铜为正极,发生还原反应;
(3)该装置是电解池,连接电源负极的是阴极,阴极上得电子发生还原反应,连接电源正极的是阳极,阳极上失电子发生还原反应,将两个电极反应式相加即得电池反应式;
(4)该装置是电解池,电能转化为化学能.
解答 解:(1)A没有外接电源,属于原电池,BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,故答案为:A; B C;
(2)铜、锌、氯化铜原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,
铜作正极,正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,反应过程溶液中c(Cu2+) 减小,
故答案为:负;还原;Cu2++2e-=Cu;变小;
(3)该装置是电解池,且阳极是惰性电极,C连接电源负极,所以是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,可观察到碳棒表面有红色物质生成,铂连接电源正极,所以铂在阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,总反应为CuCl2 $\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,
故答案为:阴极;碳棒表面有红色物质生成; Cu2++2e-=Cu;CuCl2 $\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑;
(4)该装置是电解池,电能转化为化学能,故答案为:电能转化为化学能.
点评 本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池、电解池的原理,把握电极方程式的书写,难度不大.

| A. | CCl4和PCl3 | B. | NaCl和HCl | C. | CO2和SiO2 | D. | NaH和Na2O2 |
| A. | 水蒸气与铁粉共热 | B. | 熔融氯化镁 | ||
| C. | 乙醇溶于水 | D. | 粉碎金刚石 |
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
| A. | 离子半径:O2->Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
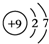 ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号); ,ED4的电子式是
,ED4的电子式是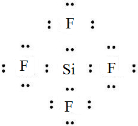 ;
; Na2O2
Na2O2
 →
→ 、MgCl2
、MgCl2 .
.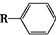 $→_{一定条件}^{CO,HCl}$
$→_{一定条件}^{CO,HCl}$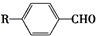 ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: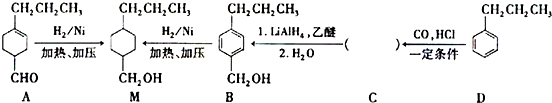
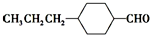 和
和 (写结构简式)生成.
(写结构简式)生成.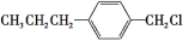 .
.