题目内容
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
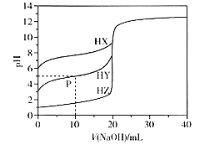
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
【答案】B
【解析】
A.起始时HA溶液pH=6,则溶液中c(H+)=c(A-)=10-6mol/L,所以Ka(HA)=![]() =
=![]() =10-11,所以数量级不是10-12,故A错误;
=10-11,所以数量级不是10-12,故A错误;
B.P点为在HY溶液中加入10mLNaOH溶液,溶液中含有等浓度的NaY和HY,溶液显酸性,说明HY的电离程度大于NaY的水解程度,所以c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),故B正确;
C.pH=7时,根据电荷守恒,溶液中均存在,c(Na+) =c(X-),c(Na+)=c(Y-) ,c(Na+)=c(Z-),三种溶液中加入的NaOH体积不等,即c(Na+)各不相同,所以c(X-)≠c(Y-)≠c(Z-),故C错误;
D.当加入10mLNaOH溶液时,HX溶液中恰好反应生成等量的HX和NaX,此时溶液显碱性,说明X-的水解程度大于HX的电离程度,故D错误;
故选B。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为_____________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸
① B的化学式为_____________,鉴别溶液B中的阴离子的方法:___________________
② D溶于稀硝酸的离子方程式为________________________________
③ D与E的混合物a g,加入足量盐酸,完全反应生成的气体在标准状况下体积为b L,则求算E在混合物中的质量分数的表达式为________________________________________
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D