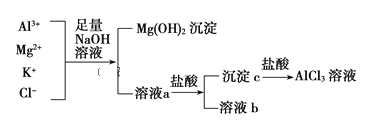
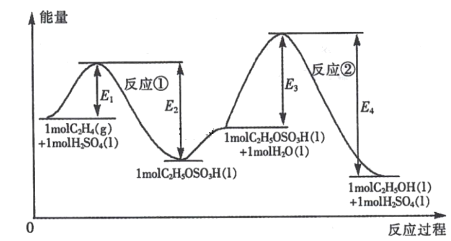
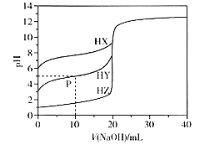
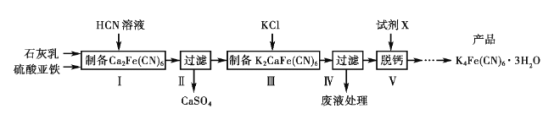
题目内容
【题目】一定温度下,0.1 mol N2(g)与0.3 mol H2(g)在恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
A.容器内气体的压强不再发生变化,说明反应达到平衡状态
B.达到化学平衡状态时,正、逆反应速率都为零
C.相同时间内,断开H—H键的数目和生成N-H键的数目相等
D.平衡时容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
【答案】A
【解析】
A.反应前后气体系数和不等,所以当气体总压强不随时间改变时,表明该反应达到平衡状态,故A正确;
B.达到化学平衡状态时,正、逆反应速率相等,但是都不为0,故B错误;
C.相同时间内,断开H-H键的数目和生成N-H键的数目相等,表示的都是正反应,且不满足计量数关系,无法判断是否为平衡状态,故C错误;
D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2,无法判断各组分的浓度是否继续变化,无法判断平衡状态,故D错误;
故选A。

练习册系列答案
相关题目