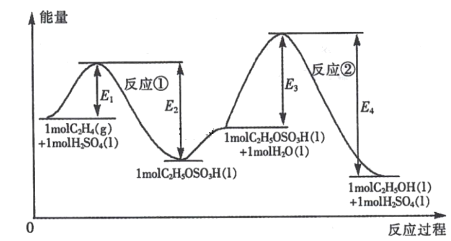
题目内容
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D
【答案】B
【解析】
A.电石的主要成分为碳化钙,与水反应产生乙炔气体,同时电石中含有杂质硫化钙等,则生成的乙炔气体中混有硫化氢气体,二者均可以与高锰酸钾发生氧化反应使其褪色, 故不能排除硫化氢的干扰,结论不正确,A项错误;
B. CH3COONa中醋酸根离子是弱酸根离子发生水解,CH3COO+ H2O![]() CH3COOH+OH,溶液显碱性,滴入酚酞变红。由于水解是吸热过程,则加热会促进水解,碱性增强,酚酞的红色加深,故可以得出结论CH3COONa溶液显碱性且存在水解平衡,结论正确,B项正确;
CH3COOH+OH,溶液显碱性,滴入酚酞变红。由于水解是吸热过程,则加热会促进水解,碱性增强,酚酞的红色加深,故可以得出结论CH3COONa溶液显碱性且存在水解平衡,结论正确,B项正确;
C.向蔗糖溶液中加入稀硫酸加热一段时间,蔗糖发生水解生成葡萄糖和果糖,若检验葡萄糖,需要在水解产物中加入NaOH溶液调节至碱性环境,然后加入新制Cu(OH)2悬浊液,加热煮沸,观察到由砖红色沉淀Cu2O生成,可证明水解产物中葡萄糖,证明蔗糖发生水解;若水解液仍为酸性环境,会与新制Cu(OH)2悬浊液发生酸碱中和,不会有砖红色沉淀。结论错误,C项错误;
D.向Na2S2O3溶液中滴加H2SO4溶液至过量:S2O32-+2 H+= S↓+ SO2↑+ H2O,一段时间后由淡黄色浑浊出现,同时有无色刺激性气味的气体生成。S2O32-中硫元素化合价+2一部分降到零价发生还原反应,一部分上升到+4发生氧化,故Na2S2O3在该反应中既作氧化剂又做还原剂,结论错误,D项错误;
答案选B。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。