题目内容
6.C、Si、N元素的电负性由大到小的顺序是N>C>Si.分析 根据元素的电负性在周期表中的递变规律判断C、Si、N元素的电负性由大到小的顺序,同周期元素从左到右元素的电负性逐渐增强,则电负性:N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,由此分析解答;
解答 解:同周期元素从左到右元素的电负性逐渐增强,则电负性:N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>C>Si,故答案为:N>C>Si.
点评 本题考查了物质结构和性质,涉及电负性的知识点,这些知识点都是考试热点,要熟练掌握这些知识点,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.对于下列装置的分析不正确的是( )
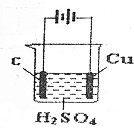

| A. | 这是一个电解池 | |
| B. | C作阴极,Cu作阳极 | |
| C. | 电解的过程实际上是电解水 | |
| D. | 石墨电极上的反应是4OH--4e-=O2↑+2H20 |
17.配制一定物质的量浓度的溶液时,由于操作方面的失误可能会导致实验误差.下列分析中正确的是( )
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
14.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是某同学配制的500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是A.
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.008 mol/L.
(3)配制上述“鲜花保鲜剂”所需的仪器有:电子天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、500ml容量瓶.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BCD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移后洗涤烧杯2-3次,并把洗涤液倒入容量瓶中
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
| 成分 | 蔗糖 | 硫酸钾 | 阿司匹林 | 高锰酸钾 | 硝酸银 |
| 质量(g) | 25.00 | 0.174 | 0.17 | 0.316 | 0.340 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.008 mol/L.
(3)配制上述“鲜花保鲜剂”所需的仪器有:电子天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、500ml容量瓶.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BCD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移后洗涤烧杯2-3次,并把洗涤液倒入容量瓶中
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
1.下列说法或做法正确的是( )
| A. | 蒸发的过程中,用酒精灯一直加热到全部固体析出 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| C. | 对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液 | |
| D. | 分液漏斗盛装的是液体,振荡后不必扭开旋塞把气体放出 |
18.相同质量的H2SO4和H3PO4具有不同的( )
| A. | 分子数 | B. | 原子数 | C. | 电子数 | D. | 氧原子数 |
15.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
(1)实验③发生的反应的离子方程式为Fe+Cu2+=Fe2++Cu.
(2)上述实验说明黑色粉末X中含有Fe3O4和Fe的混合物.
II.定量测定
根据如图所示的实验方案进行实验并记录数据:
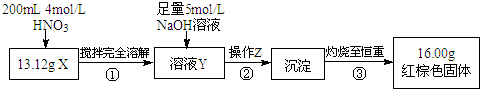
(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe:0.11mol、Fe3O4:0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(2)上述实验说明黑色粉末X中含有Fe3O4和Fe的混合物.
II.定量测定
根据如图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe:0.11mol、Fe3O4:0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
16.钠作为一种重要原料,可用于制造许多在国防工业上有重要用途的金属.下列关于钠的说法不正确的是
( )
( )
| A. | 银白色固体 | B. | 可保存在煤油中 | C. | 能与水剧烈反应 | D. | 密度比水的大 |
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管